题目内容
8.在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).(1)若开始时加入A物质m mol,B物质n mol,则达到平衡时 A、B的转化率相等.(填“相等”或“不等”)
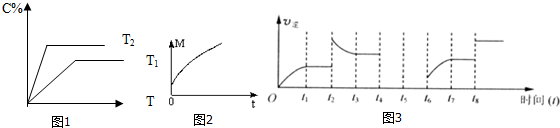
(2)相同的压强下,充入一定量的A、B后,在不同温度下C的百分含量与时间T的关系如图1所示.则T1(填“>”、“<”或“=”)<T2,该反应的正反应的△H(填“>”、“<”或“=”)>0.
(3)一定条件下,从正反应开始达到化学平衡过程中,混合气体的
平均相对分子质量随时间的变化如图2所示,测得达到平衡时
A、B、C、D的物质的量均为1mol.
①若在恒温恒容的条件下,向原平衡体系中再通入A、B、C、D
各1mol,则体系中气体的平均相对分子质量(填“增大”、“减小”、
“不变”或“无法确定”)增大.
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1mol,则体系中气体的密度(填“增大”、“减小”、“不变”或“无法确定”)不变.
(4)若该反应的逆反应速率与时间的关系如图3所示:
可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了条件,试判断t2时改变的条件是增大生成物的浓度.
分析 (1)开始时加入A物质m mol,B物质n mol,起始量符合化学方程式系数之比,依据转化率是转化量除以起始量计算分析;
(2)根据先拐先平衡,如图1中T1<T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应;
(3)根据图乙可知,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量逐渐增大的,而反应中气体质量是守恒的,所以m+n>p+q,
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D1mol,即相当于对原平衡加压,平衡向正反应方向移动,气体的平均相对分子质量会增大,据此答题;
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1mol,相当于体积增大到原来的2倍,气体的总质量也为原来的2倍,平衡不移动,气体的密度也不变,据此答题;
(4)根据速率图象分析,t2时逆反应速率瞬间变大,所以可能增加了生成物的量;根据t4时降压,t5时达到平衡,t6时增大反应物的浓度,分析绘制图象.
解答 解:(1)开始时加入A物质m mol,B物质n mol,起始量符合化学方程式系数之比,转化率是转化量除以起始量计算,所以A、B的转化率相等,故答案为:相等;
(2)根据先拐先平衡,如图1中T1<T2,温度高C的百分含量也大,所以升温平衡向正反应方向移动,故正反应为吸热反应,故答案为:<;>;
(3)根据图乙可知,从正反应开始达到化学平衡过程中,混合气体的平均相对分子质量逐渐增大的,而反应中气体质量是守恒的,根据n=$\frac{m}{M}$知该反应是一个气体体积减小的反应,即m+n>p+q,
①若在恒温恒容的条件下,向该平衡体系中再通入A、B、C、D1mol,即相当于对原平衡加压,平衡向正反应方向移动,气体的平均相对分子质量会增大,
故答案为:增大;
②若恒温恒压的条件下,向原平衡体系中再通入A、B、C、D各1mol,相当于体积增大到原来的2倍,平衡不移动,气体的密度也不变,故答案为:不变;
(4)据速率图象分析,t2时逆反应速率瞬间变大,所以可能增加了生成物的量,故答案为:增大生成物的浓度.
点评 本题考查连续多个条件改变引起v-t图的变化,反应速率、化学平衡影响因素,图象的理解应用和平衡移动原理实质是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案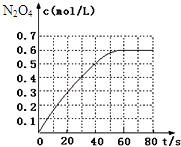 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
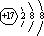 .乙的单质的电子式为
.乙的单质的电子式为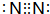 .
.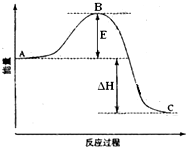 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: