题目内容
14.工业上由N2、H2合成NH3.制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.(1)水煤气变换:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数K随温度变化如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2.当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:NH3+H2O+CO2=NH4HCO3、NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2,工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计)

①起还原作用的物质是CH4.
②膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-.
③膜Ⅰ侧所得气体$\frac{n({H}_{2})}{n({N}_{2})}$=3,CH4、H2O、O2反应的化学方程式是14CH4+12H2O+O2=14CO+40H2.
分析 (1)①a.由表格数据可知,温度越高,K越小,则正反应为放热反应;
b.该反应为气体体积不变的反应,增大压强,平衡不移动;
c.增大水蒸气浓度,反应速率增大,促进CO的转化;
②以氨水为吸收剂脱除CO2,反应生成碳酸氢铵,加热时分解生成二氧化碳;
(2)发生Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),增大生成物浓度,平衡逆向移动;
(3)由图可知,C失去电子生成CO,膜Ⅰ侧氧气、水得到电子,结合电极反应来解答.
解答 解:(1)①a.由表格数据可知,温度越高,K越小,则正反应为放热反应,则△H<0,故正确;
b.该反应为气体体积不变的反应,增大压强,平衡不移动,不能提高转化率,故错误;
c.增大水蒸气浓度,反应速率增大,促进CO的转化,则可以同时增大CO的平衡转化率和反应速率,故正确;
故答案为:a c;
②以氨水为吸收剂脱除CO2.当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程吸收:NH3+H2O+CO2=NH4HCO3、NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,
故答案为:NH3+H2O+CO2=NH4HCO3、NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑;
(2)发生Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),增大生成物浓度,平衡逆向移动,则H2O(g)的作用为Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原,
故答案为:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原;
(3)①C失去电子,则起还原作用的物质是CH4,故答案为:CH4;
②膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-,故答案为:H2O+2e-=H2+O2-、O2+4e-=2O2-;
③空气中N2与O2的物质的量之比为4:1,膜Ⅰ侧所得气体$\frac{n({H}_{2})}{n({N}_{2})}$=3,氮气在反应前后不变,设氮气为4mol,则生成氢气为12mol,由膜I侧反应可知12molH2O得到电子、1molO2得到电子,膜I上发生12H2O+24e-=12H2+12O2-、O2+4e-=2O2-,膜II上14molCH4中C失去84mol电子、H得到56mol电子时,总反应遵循电子守恒,则反应为14CH4+12H2O+O2=14CO+40H2,故答案为:14CH4+12H2O+O2=14CO+40H2.
点评 本题考查化学平衡及原电池,为高频考点,把握表格数据、图象分析、平衡移动原理及电极反应为解答的关键,侧重分析与应用能力的考查,注意信息的应用,题目难度较大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案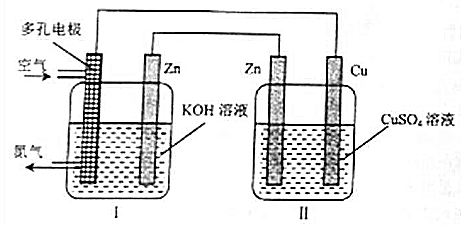
| A. | Cu电极质量增加 | |
| B. | 装置Ⅱ将化学能转变为电能 | |
| C. | 装置Ⅰ中OH-向多孔电极移动 | |
| D. | 多孔电极的电极反应式为:O2+4e-+2H2O═4OH- |
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
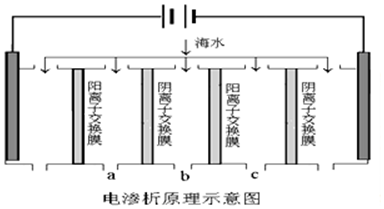
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
| A. | Y、Z、W的简单离子半径Z>W>Y | B. | 工业上制取Y可用电解YW3制得 | ||
| C. | XW2中各原子均达到8电子结构 | D. | Z、W的氧化物对应水化物的酸性Z<W |

下列说法正确的是( )
| A. | 原料甲与苯酚互为同系物 | |
| B. | 中间产物乙、丙和多巴胺都具有两性 | |
| C. | 多巴胺不可能存在氨基酸类的同分异构体 | |
| D. | 1 mol甲最多可以和2 mol Br2发生取代反应 |
| A. | 二氧化硅可用来制造太阳能电池 | |
| B. | 需要加热才能进行的反应一定是吸热反应 | |
| C. | 铜的金属性比铝弱,可以用铜罐贮运浓硝酸 | |
| D. | NaOH溶液不能保存在带磨口玻璃塞的试剂瓶中 |
| A. | 金刚石比石墨稳定 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 若在等量氧气中充分燃烧,1mol金刚石比1mol石墨的释放的能量高 | |
| D. | 仅提供1.895 kJ的热能,工业上就能将1mol石墨转化为金刚石 |
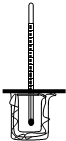 如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.
如图所示,大烧杯中放入一小烧杯,两烧杯间空隙用碎纸屑填充,小烧杯上方悬挂一温度计,两烧杯口共盖一泡沫塑料,构成一套简易测量温度变化装置.