题目内容
2.某地海水中主要离子的含量如表:| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
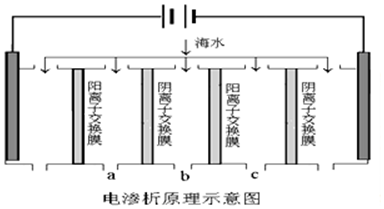
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
分析 A.开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀;
B.Cl-放电能力大于OH-;
C.阴(阳)离子交换膜只允许阴(阳)离子通过;
D.电解时b室中阴离子移向a室,阳离子移向c室,所以b室中物质主要是水.
解答 解:A.开始电解时,阳极上氯离子放电生成氯气,阴极上水得电子生成氢气同时生成OH-,生成的OH-和HCO3-反应生成CO32-,Ca2+转化为CaCO3沉淀,所以电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O,故A正确;
B.Cl-放电能力大于OH-,所以阳极的电极反应式为2Cl--2e-═Cl2↑,故B错误;
C.阴(阳)离子交换膜只允许阴(阳)离子通过,所以电解时b室中阴离子移向a室,阳离子移向c室,故C正确;
D.电解时b室中阴离子移向a室,阳离子移向c室,所以b室中物质主要是水,则淡水的出口为b出口,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,明确离子放电顺序及离子之间的反应是解本题关键,知道各个室产生物质成分,题目难度不大.

练习册系列答案
相关题目
8.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 18.4mol/L的硫酸溶液.
①滴入几滴浓盐酸
②加NaCl溶液
③滴入几滴硫酸铜溶液
④升高温度(不考虑盐酸挥发)
⑤改用 18.4mol/L的硫酸溶液.
| A. | ①③④ | B. | ②④ | C. | ①④ | D. | ①④⑤ |
9.下列有关性质的比较,不能用元素周期律解释的是( )
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Mg | C. | 稳定性:HF>CH4 | D. | 酸性:HF<HCl |
10.下列有关实验的叙述正确的是( )
| A. | 将10%的葡萄糖溶液加入新制氢氧化铜悬浊液中,加热可得到砖红色沉淀 | |
| B. | 苯加入到溴水中,苯和溴发生取代反应而使溴水褪色 | |
| C. | 在洁净的试管中加入1~2 mL AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 |
17.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图.若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的•OH(羟基自由基).下列说怯错误的是( )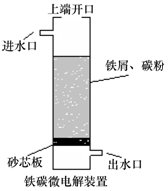

| A. | 无论是否鼓入空气,负极的电极反应式均为Fe-2e-═Fe2+ | |
| B. | 不鼓入空气时,正极的电极反应式为H++e-═H | |
| C. | 鼓入空气时,每生成1mol•OH有2mol电子发生转移 | |
| D. | 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气 |
14.工业上由N2、H2合成NH3.制备H2需经多步完成,其中“水煤气(CO、H2)变换”是纯化H2的关键一步.
(1)水煤气变换:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数K随温度变化如表:
①下列分析正确的是ac.
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2.当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:NH3+H2O+CO2=NH4HCO3、NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
结合化学方程式解释H2O(g)的作用:Fe3O4(s)+4H2(g)?3Fe(s)+4H2O(g),加入H2O(g)后抑制Fe3O4被H2进一步还原.
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2,工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计)

①起还原作用的物质是CH4.
②膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-.
③膜Ⅰ侧所得气体$\frac{n({H}_{2})}{n({N}_{2})}$=3,CH4、H2O、O2反应的化学方程式是14CH4+12H2O+O2=14CO+40H2.
(1)水煤气变换:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数K随温度变化如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2.当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:NH3+H2O+CO2=NH4HCO3、NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(2)Fe3O4是水煤气变换反应的常用催化剂,经CO、H2还原Fe2O3制备.两次实验结果如表:
| 实验Ⅰ | 实验Ⅱ | |
| 通入气体 | CO、H2 | CO、H2、H2O(g) |
| 固体产物 | Fe3O4、Fe | Fe3O4 |
(3)2016年我国某科研团队利用透氧膜,一步即获得N2、H2,工作原理如图所示.(空气中N2与O2的物质的量之比按4:1计)

①起还原作用的物质是CH4.
②膜Ⅰ侧发生的电极反应式是H2O+2e-=H2+O2-、O2+4e-=2O2-.
③膜Ⅰ侧所得气体$\frac{n({H}_{2})}{n({N}_{2})}$=3,CH4、H2O、O2反应的化学方程式是14CH4+12H2O+O2=14CO+40H2.
11.六种短周期元素A、B、C、D、E、F的原子序数依次增大,只有E是金属元素,其一种核素的质量数为28,中子数比质子数多2,B是自然界中形成物质种类最多的元素,D是地壳中含量最多的元素;A、C、E、F原子最外层电子数为互不相等的奇数,且A、C、F原子最外层电子数之和恰好等于E元素的核电荷数,A与F最高化合价之和为8,下列说法正确的是( )
| A. | A、C、D三种元素形成的化合物一定是共价化合物 | |
| B. | 工业上常用电解E与F形成的化合物的方法制取单质E | |
| C. | 原子半径由大到小的顺序:D>C>B>A | |
| D. | B、C、F元素最高价氧化物水化物酸性最强的是F |
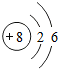 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
. .
.