题目内容
7.钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、Al2O3、SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4•7H2O.请回答下列问题: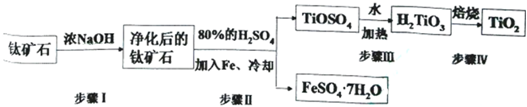
(l)步骤I的目的是除去Al2O3和SiO2
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O.
(3)步骤II中经过蒸发浓缩、冷却结晶、过滤、洗涤等操作可以得到FeSO4•7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O
(4)请结合化学用语用化学平衡理论解释步骤Ⅲ中将TiOSO4转化为H2TiO3的原理:溶液中存在平衡:TiO2++2H2O=H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10mL加水稀释至100mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++Al3++3H2O.过滤后,取出滤液20.00mL,以KSCN溶液为指示剂,用0.1000mol•L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL.
①该滴定达到终点时的现象当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点
②待测钛液中TiOSO4的物质的量浓度是1.50mol•L-1.
分析 以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、Al2O3、SiO2等杂质)为主要原料经过以下流程制得TiO2:向矿石中加入浓的氢氧化钠溶液,Al2O3、SiO2溶于氢氧化钠溶液,净化后的钛矿石主要含FeTiO3钛酸亚铁、FeO,加入80%的硫酸和铁,发生反应:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O、FeO+H2SO4=FeSO4+H2O,冷却经过蒸发浓缩、冷却结晶、过滤、洗涤等操作可以得到副产品FeSO4•7H2O,向TiOSO4中加水:TiO2++2H2O=H2TiO3+2H+,生成H2TiO3,焙烧得到TiO2,据此分析解答.
解答 解:(1)步骤I向钛矿石加入浓氢氧化钠,Al2O3和SiO2 能溶于氢氧化钠,净化矿石;
故答案为:除去Al2O3和SiO2;
(2)由流程步骤Ⅱ中FeTiO3与H2SO4发生反应生成TiOSO4和FeSO4,化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;
故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;
(3)经过蒸发浓缩、冷却结晶、过滤、洗涤等操作可以得到副产品FeSO4•7H2O;用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰,则亚铁生成铁离子,离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;
故答案为:蒸发浓缩、冷却结晶;MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;
(4)TiOSO4溶液中存在平衡:TiO2++2H2O=H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
故答案为:溶液中存在平衡:TiO2++2H2O=H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;
(5)①Ti3+与NH4Fe(SO4)2溶液中的铁离子反应,当Ti3+反应完,溶液中铁离子使溶液显红色,则当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;
故答案为:当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;
②设滤液Ti3+的物质的量为X.
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
1 1
X 0.1000mol•L-1×0.03L
解得X=0.1000mol•L-1×0.03L=0.003mol
则待测钛液中TiOSO4的物质的量=0.003mol×5=0.015mol
根据C=$\frac{n}{V}$=$\frac{0.0015mol}{0.01L}$=1.50 mol•L-1
故答案为:1.50 mol•L-1.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、氧化还原滴定、学生的阅读、分析、提取信息解决问题的能力,主要是化学工艺流程,题目难度较大,做题时注意从物质的性质角度结合题中信息解答.

 名校课堂系列答案
名校课堂系列答案| A. | d1=d2 | B. | d1>d2 | C. | d1<d2 | D. | 无法确定 |
| A. | 电泳现象可证明胶体带电 | |
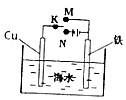
| B. | 如图装置,无论电键K接M还是接N,铁都能得到保护 | |
| C. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| D. | 由反应2Fe2++Br2═2Fe3++2Br-可知,将1molCl2通入含1molFeBr2的溶液中能发生反应的离子方程为;2Cl2+2Fe2++2Br-═2Fe3++Br2+4Cl- |
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 1molO2中约含有6.02×1023个O2 | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 摩尔表示物质的量 |
| A. | 环己烯 | B. | 丙烯 | C. | 乙烷 | D. | 氯乙烯 |
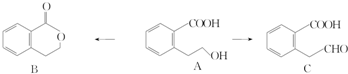
 (或
(或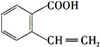 ),A分子中一定共面的碳原子有8个.
),A分子中一定共面的碳原子有8个.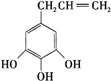 (或
(或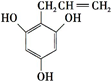 )(任写一种).
)(任写一种).