题目内容
17.下列分子中,所有原子都处在同一平面的是( )| A. | 环己烯 | B. | 丙烯 | C. | 乙烷 | D. | 氯乙烯 |
分析 碳碳双键为平面结构,与双键C直接相连的C一定共面,甲基、亚甲基中C均为四面体构型,以此来解答.
解答 解:A.环己烯含碳碳双键,但含4个亚甲基,不可能所有原子共面,故A错误;
B.丙烯中含碳碳双键、甲基,甲基中C均为四面体构型,不可能所有原子共面,故B错误;
C.乙烷中C均为四面体构型,不可能所有原子共面,故C错误;
D.含碳碳双键,均与双键C之间相连,则所有原子都处在同一平面,故D正确;
故选D.
点评 本题考查有机物的结构,为高频考点,把握常见有机物的构型为解答的关键,侧重分析与应用能力的考查,注意甲基、亚甲基与甲烷的结构应用,题目难度不大.

练习册系列答案
相关题目
8.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊. | 碳酸的酸性比苯酚的强 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2S O4)<Ksp(Ca2S O4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe2+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
12.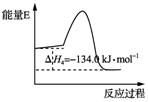 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1
反应②:C(s)+H2O(g)?CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.1kJ•mol-1
反应④:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H4,能量变化如图所示
反应⑤:3CH3OH(g)?CH3CH═CH2(g)+3H2O(g)△H5=-31.0kJ•mol-1
下列说法正确的是( )
 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )反应①:C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1
反应②:C(s)+H2O(g)?CO(g)+H2(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.1kJ•mol-1
反应④:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H4,能量变化如图所示
反应⑤:3CH3OH(g)?CH3CH═CH2(g)+3H2O(g)△H5=-31.0kJ•mol-1
下列说法正确的是( )
| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
2.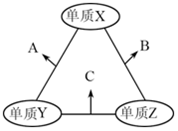 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |
9.下列物质中,可溶于水的是( )
| A. | 胆固醇: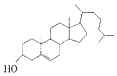 | B. | 芬必得: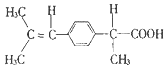 | ||
| C. | 保幼激素JH-I: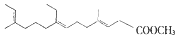 | D. | 维生素C: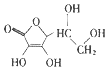 |
6. 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )| A. | x可能等于2也可能等于3 | |
| B. | 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数不变 | |
| C. | 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 | |
| D. | 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol•L-1<c(A)<0.5mol•L-1 |
2.在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体.
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
(4)某同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
(1)该过程的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是BC.

(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分.试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸.
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液,振荡,观察 | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸,再加入少许AgNO3溶液振荡,观察 | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{a-\frac{84b}{31}}{a}$(用含a、b的代数式表示)
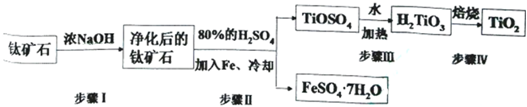
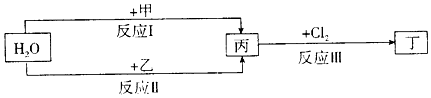
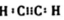 .
.