题目内容
12.净水丸能对饮用水进行快速杀苗消毒,倍受人们青眯.药丸分内外两层.使用时,直接将它投入适量的水中,外层的优氯净(C3O3N3Cl2Na)先与水反应,生成的次氯酸(HClO)起杀菌消毒作用;几分钟后.内层的亚硫酸钠(Na2SO3)将水中的余氯(次氯酸等)除去.回答下列问题:(1)C3O3N3Cl2Na由5种元素组成.
(2)HClO中氧元素的化合价为+1.
(3)净化水除了上述方法外.请你另举一例:蒸馏等.
(4)除去余氯的反应之一为:Na2SO3+HClO=Na2SO4+X,X的化学式为HCl.
(5)使用净水丸时.能否先破碎后使用?不能 (填”能”或“不能”)
分析 (1)由化学式可知物质的组成元素;
(2)化合物中正负化合价的倒数和为0;
(3)强氧化性可杀菌消毒,还可用过滤、蒸馏法等;
(4)Na2SO3+HClO=Na2SO4+X中遵循质量守恒定律;
(5)先破碎后内层的亚硫酸钠(Na2SO3)被氧化,不能用于余氯(次氯酸等)除去,以此来解答.
解答 解:(1)由化学式C3O3N3Cl2Na可知该物质由C、O、N、Cl、Na五种元素组成,故答案为:5;
(2)根据化合物中各元素化合价代数和为0,HCl0中氯元素的化合价为0-(+1)-(-2)=+1,故答案为:+1;
(3)沉淀、过滤、消毒杀菌、蒸馏等都是常用的净化水的方法,使用该净水丸为消毒杀菌的方法净化水,故答案为:蒸馏等;
(4)由反应的化学方程式Na2SO3+HClO=Na2SO4+X,根据反应前后原子种类、个数不变,生成物X的分子由2个H原子、1个Cl原子构成,则物质X的化学式为HCl,故答案为:HCl;
(5)由于外层的优氯净先与水反应,生成的次氯酸(HClO)起杀菌消毒作用,然后内层的亚硫酸钠(Na2S03)将水中的余氯(次氯酸等)除去,因此该净水丸不能破碎后使用,故答案为:不能.
点评 本题考查物质的性质,为高频考点,把握物质的组成、性质、性质与用途等为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
12.将Na、Na2O、Na2O2的混合物4.34g与足量的水反应,标准状况下得到672mL混合气体,放电条件下,气体之间恰好完全反应,则它们的物质的量之比为( )
| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:2 | D. | 4:3:2 |
13.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
10.设NA为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A. | 23gNa与氧气充分燃烧,转移的电子数为NA | |
| B. | 1mol甲醇中含有的共价键数为4NA | |
| C. | 46gNO2和N2O4的混合气体含有的原子数为2NA | |
| D. | 标准状况下,22.4L氨水含有NH3分子数为NA |
4.化学与生活、社会密切相关.下列说法正确的是( )
| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和柴油均为石油分馏得到的产品 | |
| C. | CaCO3可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、蛋白质溶于水均能形成胶体 |
2.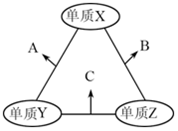 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
 X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )
X、Y、Z是原子序数依次增大的三种短周期元素,三种元素的原子序数之和为35,且Z的原子序数是X的原子序数的2倍.X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,下列说法不正确的是( )| A. | 元素X,Z的单质均存在同素异形体 | B. | A和C溶于水,溶液均显碱性 | ||
| C. | A和B都可能具有漂白性 | D. | Z的氧化物的水化物一定是强酸 |