题目内容
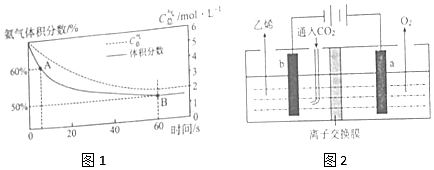
20.25℃时,向10mL0.1mol/L H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH 与所加NaOH 溶液的体积关系如图所示.下列叙述正确的是( )
| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
分析 根据图知,D点二者恰好完全反应生成正盐,但溶液的pH>7,说明该盐是强碱弱酸盐,则H2A为弱酸;
B点酸碱恰好完全反应生成NaHA,溶液pH<7,呈酸性,说明酸根离子电离程度大于水解程度;
Na2A为强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则V(NaOH)<20mL,C点呈中性,溶液中溶质为Na2A、NaHA,且c(Na2A)>c(NaHA);
D点溶质为Na2A,
A.NaHA为弱酸酸式盐,为强电解质,电离生成钠离子和酸式酸根离子;
B.根据电荷守恒、物料守恒判断;
C.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒判断;
D.D点溶质为Na2A,酸根离子两步水解都生成OH-,只有一步水解生成HA-.
解答 解:根据图知,D点二者恰好完全反应生成正盐,但溶液的pH>7,说明该盐是强碱弱酸盐,则H2A为弱酸;
B点酸碱恰好完全反应生成NaHA,溶液pH<7,呈酸性,说明酸根离子电离程度大于水解程度;
Na2A为强碱弱酸盐,其水溶液呈碱性,要使混合溶液呈中性,则V(NaOH)<20mL,C点呈中性,溶液中溶质为Na2A、NaHA,且c(Na2A)>c(NaHA);
D点溶质为Na2A,
A.NaHA为弱酸酸式盐,为强电解质,完全电离生成钠离子和酸式酸根离子,其电离方程式为NaHA=Na++HA-,故A错误;
B.根据电荷守恒、物料守恒得c(Na+)=c(A2-)+c(HA-)+(H2A),根据电荷守恒得:c(Na+)+c(H+)=c(OH-)+2c(A2-)+c(HA-),所以得c(H2A)+c(H+)=c(OH-)+c(A2-),故B正确;
C.溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得c(Na+)=2c(A2-)+c(HA-),故C错误;
D.D点溶质为Na2A,酸根离子两步水解都生成OH-,只有一步水解生成HA-,所以c(HA-)<c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,明确图中各点溶液中溶质成分及其性质是解本题关键,知道溶液中存在的守恒,易错选项是D,根据其微粒来源确定c(OH-)、c(HA-)相对大小,题目难度不大.

 发散思维新课堂系列答案
发散思维新课堂系列答案| X | Y | |
| Z |
| A. | Y的单质与水反应时,Y的单质既是氧化剂又是还原剂 | |
| B. | X的最高价氧化物对应的水化物与其气态氢化物可以反应生成盐 | |
| C. | X、Y、Z元素形成的单质,常温下Z单质的沸点最底 | |
| D. | X的氢化物只有一种 |
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
| A. | 常温下,5.6g金属铁投入足量的浓硫酸中,电子转移数为0.3NA | |
| B. | 18g D2O所含的中子数为10NA | |
| C. | 标准状况下,8 gSO3所含原子数为0.4NA | |
| D. | 常温下,1.0LpH=13的Ba (OH) 2溶液中含有的OH-数目为0.2NA |
| A. | 配制一定物质的量浓度溶液中,洗净的容量瓶要放进烘箱中烘干,以防溶液被稀释 | |
| B. | 测量Zn与稀硫酸反应速率的实验中,应在标准状况下测量H2的体积,以方便计算 | |
| C. | 酸碱滴定实验中,用待测溶液润洗锥形瓶,以减少实验误差 | |
| D. | 中和热的测定实验中,要用环形玻璃搅拌棒搅拌,使反应更充分 |
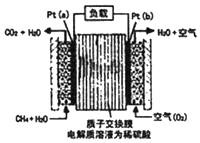 某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )
某种甲烷燃料电池采用铂作电极,电池中的质子交换膜只允许质子和水分子通过,其基本结构如图,电池总反应为:CH4+2O2═CO2+2H2O.下列有关说法正确的是( )| A. | 电子由a极流出经过负载流向b极 | |
| B. | 电解质溶液中H+移向a极 | |
| C. | 每转移1mole-,消耗1.6gCH4 | |
| D. | b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
| A. | 氨水和盐酸 | B. | 氢氧化钠溶液和醋酸 | ||
| C. | 硫酸和氢氧化钡溶液 | D. | 硝酸和石灰水 |