题目内容
8.设NA为阿伏加德罗常数值,下列有关叙述正确的是( )| A. | 常温下,5.6g金属铁投入足量的浓硫酸中,电子转移数为0.3NA | |
| B. | 18g D2O所含的中子数为10NA | |
| C. | 标准状况下,8 gSO3所含原子数为0.4NA | |
| D. | 常温下,1.0LpH=13的Ba (OH) 2溶液中含有的OH-数目为0.2NA |
分析 A、常温下,铁在浓硫酸中会钝化;
B、重水的摩尔质量为20g/mol;
C、求出三氧化硫的物质的量,然后根据三氧化硫中含4个原子来分析;
D、pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L.
解答 解:A、常温下,铁在浓硫酸中会钝化,反应程度很小,故转移的电子数小于0.3NA个,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,而重水中含10个中子,故0.9mol重水中含9NA个中子,故B错误;
C、8g三氧化硫的物质的量为n=$\frac{8g}{64g/mol}$=0.125mol,而三氧化硫中含4个原子,故0.125mol三氧化硫中含0.4mol即0.4NA个原子,故C正确;
D、pH=13的氢氧化钡溶液中,氢氧根浓度为0.1mol/L,故1L溶液中含有的氢氧根的物质的量为0.1mol,个数为0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
4.下列说法正确的是( )
| A. | 1mol蔗糖完全水解生成葡萄糖分子数为2 NA | |
| B. | 在氢氧碱性燃料电池中,若正极消耗22.4L气体(标准状况),则转移电子数为2NA | |
| C. | 16.0 gCuO和Cu2S的混合物含阴离子数为0.2NA | |
| D. | 2.24L(标准状况)一氯甲烷分子中含共价键数为0.4NA |
3.以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2+4Fe3+?Cu2++5Fe2++2S.
(1)该反应中,Fe3+体现氧化性.
(2)上述总反应的原理如图1所示.负极的电极反应式是CuFeS2-4e-═Fe2++2S+Cu2+.
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
①对比实验 I、II,通入空气,Cu2+浸出率提高的原因是通入O2后,发生反应4Fe2++O2+4H+═4Fe3++2H2O,c(Fe2+)降低,c(Fe3+)升高,总反应的平衡正向移动.
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L-1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中无明显现象,证明发生反应 i.
b.取少量Ag2S粉末,加入pH=1的0.10mol•L-1Fe2(SO4)3溶液溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示:
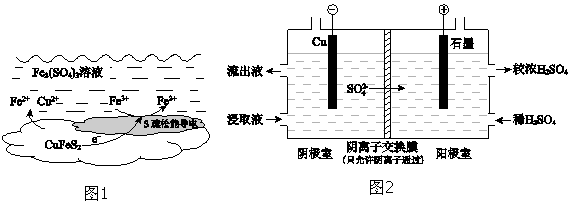
①电解初期,阴极没有铜析出.用电极反应式解释原因是Fe3++e-═Fe2+.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生.
(1)该反应中,Fe3+体现氧化性.
(2)上述总反应的原理如图1所示.负极的电极反应式是CuFeS2-4e-═Fe2++2S+Cu2+.
(3)一定温度下,控制浸取剂pH=1,取三份相同质量黄铜矿粉末分别进行如下实验:
| 实验 | 操作 | 2小时后Cu2+浸出率/% |
| I | 加入足量0.10mol•L-1 Fe2(SO4)3溶液 | 78.2 |
| II | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
| III | 加入足量0.10mol•L-1 Fe2(SO4)3溶液,再加入少量0.0005mol•L-1 Ag2SO4溶液 | 98.0 |
②由实验 III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+═Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+═2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol•L-1 Ag2SO4溶液,充分混合后静置.取上层清液,加入稀盐酸,观察到溶液中无明显现象,证明发生反应 i.
b.取少量Ag2S粉末,加入pH=1的0.10mol•L-1Fe2(SO4)3溶液溶液,充分混合后静置.取上层清液,加入稀盐酸,有白色沉淀,证明发生反应 ii.
(4)用实验 II的浸取液电解提取铜的原理如图2所示:

①电解初期,阴极没有铜析出.用电极反应式解释原因是Fe3++e-═Fe2+.
②将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是Fe2+在阳极失电子生成Fe3+:Fe2+-e-═Fe3+,SO42-通过阴离子交换膜进入阳极室,Fe2(SO4)3溶液再生.
13.丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是( )
CH2=CH-COOH+H2O$\stackrel{一定条件}{→}$
CH2=CH-COOH+H2O$\stackrel{一定条件}{→}$

| A. | 该反应为加成反应,没有副产物生成 | |
| B. | 可用Br2/CCl4溶液鉴别丙烯酸和乳酸 | |
| C. | 丙烯酸与乳酸都属于有机酸,两者不发生反应 | |
| D. | 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1 |
20.25℃时,向10mL0.1mol/L H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH 与所加NaOH 溶液的体积关系如图所示.下列叙述正确的是( )

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |

 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.

 ,反应①~⑤中属于取代反应的有①.
,反应①~⑤中属于取代反应的有①. .
. 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或
(或 )(任写一种)
)(任写一种) 和其他无机试剂合成
和其他无机试剂合成  最合理的方案.
最合理的方案.