题目内容
9.能用离子方程式 H++OH-→H2O 表示的反应是( )| A. | 氨水和盐酸 | B. | 氢氧化钠溶液和醋酸 | ||
| C. | 硫酸和氢氧化钡溶液 | D. | 硝酸和石灰水 |
分析 离子方程式 H++OH-=H2O 表示强酸与强碱反应生成盐和水的一类反应,据此进行解答.
解答 解:A.氨水为弱碱,一水合氨按不能拆开,该反应的离子方程式为:H++NH3•H2O=NH4++H2O,不能用离子方程式 H++OH-=H2O 表示,故A错误;
B.醋酸为弱酸,离子方程式中不能拆开,该反应的离子方程式为:CH3COOH+OH-=CH3COO-+H2O,不能用离子方程式 H++OH-=H2O 表示,故B错误;
C.硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,该反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用离子方程式 H++OH-=H2O 表示,故C错误;
D.石灰水中的氢氧化钙在离子方程式中需要拆开,该反应可以用离子方程式 H++OH-=H2O表示,故D正确;
故选D.
点评 本题考查离子方程式的书写方法,题目难度不大,明确离子方程式表示的意义为解答关键,注意掌握离子方程式的书写原则,试题有利于提高学生的规范答题能力.

练习册系列答案
相关题目
20.25℃时,向10mL0.1mol/L H2A溶液中滴加等浓度的NaOH溶液,混合后溶液的pH 与所加NaOH 溶液的体积关系如图所示.下列叙述正确的是( )

| A. | NaHA的电离方程式为NaHA?Na++HA- | B. | B点:c(H2A)+c(H+)=c(OH-)+c(A2-) | ||
| C. | C点:c(Na+)=c(A2-)+c(HA-) | D. | D点:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
4.14C 常用于测定年代,关于其说法正确的是( )
| A. | 比 12C 多两个质子 | B. | 与 12C 化学性质相似 | ||
| C. | 与 12C 互为同素异形体 | D. | 质子数与中子数相等 |
14.在含有大量H+、Ca2+、Cl-溶液中,还可以大量共存的离子是( )
| A. | OH- | B. | CO32- | C. | Ag+ | D. | Mg2+ |
2.在一密闭容器内有4种物质,通过电火花引燃后发生充分反应,测得反应前后各物质的质量如下表
已知丁的相对分子质量为甲的2倍,则该反应的化学方程式中甲与丁的化学计量数的比为( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
20.胡炳成教授团队经过多年的刻苦钻研,通过氧化断裂的方式选择性地切断芳基五唑分子中 的C-N键(如图)首次制得室温下稳定的含能材料(N5)6(H3O)3(NH4)4Cl(PHAC),热分析结果显示PHAC分解温度高达116.8℃,具有非常好的热稳定性.下列说法错误的是( )


| A. | 反应表明拆开N-C键比N-N键容易 | B. | 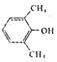 属于芳香醇的异构体有5种 属于芳香醇的异构体有5种 | ||
| C. | PHAC是一种酸式盐 | D. | PHAC能用于制造高能炸药 |

 MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体.
MnCl2+Cl2↑+H2O.装置B中盛放的试剂为饱和食盐水,其作用为除去氯气中的氯化氢气体. .
.

 ,反应①~⑤中属于取代反应的有①.
,反应①~⑤中属于取代反应的有①. .
. 有多种同分异构体,请写出符合下列条件的同分异构体的结构简式
有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或
(或 )(任写一种)
)(任写一种) 和其他无机试剂合成
和其他无机试剂合成  最合理的方案.
最合理的方案.