题目内容
已知稀溴水与稀铁盐溶液的颜色相近,均呈黄色;Cl2能将Fe2+氧化为Fe3+;Fe3+能将I-氧化为I2.某化学小组通过实验对Br2能否将Fe2+氧化为Fe3+进行了探究.
请你参与该小组的学习活动,并回答有关问题.
【实验操作】向20mLFeSO4溶液中滴加一定量的浓溴水,振荡.
【实验现象】溶液由浅绿色变为黄色.
(1)溶液呈黄色的原因可能是 (填序号);
A.Br2完全反应,将Fe2+氧化为Fe3+
B.Br2未参加反应,滴入溶液后被稀释
C.溶液中既有生成的Fe3+,又有过量的Br2
(2)为进一步确认Br2能否氧化Fe2+,该小组同学又采取三种方案进行了实验:
(3)另取20mL上述FeSO4溶液,向其中通入Cl2.若Fe2+恰好完全转化为Fe3+,消耗的Cl2在标准状况下的体积为0.336L,则该FeSO4溶液的物质的量浓度为 mol/L.
请你参与该小组的学习活动,并回答有关问题.
【实验操作】向20mLFeSO4溶液中滴加一定量的浓溴水,振荡.
【实验现象】溶液由浅绿色变为黄色.
(1)溶液呈黄色的原因可能是
A.Br2完全反应,将Fe2+氧化为Fe3+
B.Br2未参加反应,滴入溶液后被稀释
C.溶液中既有生成的Fe3+,又有过量的Br2
(2)为进一步确认Br2能否氧化Fe2+,该小组同学又采取三种方案进行了实验:
| 方案 | 操作 | 实验现象及结论 | 结沦是 否可靠 | 判断依据 |
| 甲 | 取少量黄色溶液,加入四氯化碳,振荡、静置. | 下层溶液呈橙红色,证明Br2不能将Fe2+氧化为Fe3+. | ① | ② (填文字) |
| 乙 | 取少量黄色溶液,加入 几滴淀粉碘化钾溶液. | 溶液变为蓝色,证明Br2能 将Fe2+氧化为Fe3+. | ③ | ④ (写离子方程式) |
| 丙 | 取少量黄色溶液,加入 几滴 ⑤ | 溶液变为红色,证明Br2能 将Fe2+氧化为Fe3+. | 可靠 | 1 |
考点:氯、溴、碘的性质实验,铁及其化合物的性质实验
专题:实验设计题
分析:(1)溶液由浅绿色(近乎无色)变成黄色,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色;
(2)进一步探究溴水和FeSO4溶液是否发生了反应的实验过程,依据步骤和反应现象分析判断;生成三价铁离子是最简单的检验方法;检验溴的存在判断,溴单质可能反应后过量,也可以不反应都会产生对应现象;检验时加入氢氧化钠溶液最终生成红褐色沉淀,可以是氢氧化亚铁氧化得到;
(3)根据氯气氧化二价铁的方程式来计算.
(2)进一步探究溴水和FeSO4溶液是否发生了反应的实验过程,依据步骤和反应现象分析判断;生成三价铁离子是最简单的检验方法;检验溴的存在判断,溴单质可能反应后过量,也可以不反应都会产生对应现象;检验时加入氢氧化钠溶液最终生成红褐色沉淀,可以是氢氧化亚铁氧化得到;
(3)根据氯气氧化二价铁的方程式来计算.
解答:
解:(1)溶液由浅绿色(近乎无色)变成黄色.,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色,所以选项溶液颜色发生改变的原因可能是ABC,故答案为:ABC;
(2)甲:取少量黄色溶液,加入四氯化碳,振荡,下层溶液呈橙红色,不一定说明未发生化学反应,若溴水过量,加入四氯化碳也会发生上述现象;
乙:取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的三价铁离子会氧化碘离子生成单质碘,溴单质过量也可以出现此现象,发生的可能反应为:Br2+2I-=I2+2Br-;
丙:中根据溶液变红色,说明是检验三价铁的反应,根据三价铁遇KSCN溶液呈血红色;
故答案为:
(3)根据Cl2+2Fe2+=2Cl-+2Fe3+反应,则消耗的二价铁的物质的量为
×2=0.03mol,所以FeSO4溶液的物质的量浓度为
=1.5mol/L;
故答案:1.5.
(2)甲:取少量黄色溶液,加入四氯化碳,振荡,下层溶液呈橙红色,不一定说明未发生化学反应,若溴水过量,加入四氯化碳也会发生上述现象;
乙:取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的三价铁离子会氧化碘离子生成单质碘,溴单质过量也可以出现此现象,发生的可能反应为:Br2+2I-=I2+2Br-;
丙:中根据溶液变红色,说明是检验三价铁的反应,根据三价铁遇KSCN溶液呈血红色;
故答案为:
| 方案 | 操作 | 实验现象及结论 | 结沦是 否可靠 | 判断依据 |
| 甲 | ①不可靠 | ②溴水可能过量,下层溶液也呈橙红色 | ||
| 乙 | ③不可靠 | ④Br2+2I-=I2+2Br- | ||
| 丙 | ⑤KSCN |
| 0.336L |
| 22.4L/mol |
| 0.03mol |
| 0.02L |
故答案:1.5.
点评:本题考查了实验探究的过程和分析,主要是反应是否进行的实验设计方案的假设和验证,现象的判断应用,反应的产物判断,铁及其化合物性质的应用;

练习册系列答案
相关题目
下列元素中价电子排布不正确的是( )
| A、V:3d34s2 |
| B、Cr:3d44s2 |
| C、Ar:3s23p6 |
| D、Ni:3d84s2 |
下列离子中外层d轨道达半充满状态的是( )
| A、Cr3+ |
| B、Cu+ |
| C、Co3+ |
| D、Fe3+ |
已知铬的价电子排布式为3d54s1,电负性为1.66,I1=652.9KJ/mol,I2=aKJ/mol;锰的价电子排布式为3d54s2,电负性为1.59,I1=717.3KJ/mol,I2=bKJ/mol.下列说法不正确的是( )
| A、锰、铬都是d区元素 |
| B、锰的未成对电子数比铬的多 |
| C、a>b |
| D、a、b的值取决于铬锰的核外电子排布 |


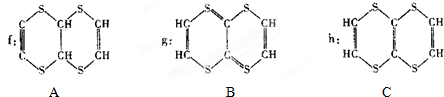
 已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1:
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A.其结构如图1: