题目内容
某元素原子序数为33,则
(1)此元素原子的电子总数是 ,有 个未成对电子.
(2)有 各电子层, 个能级, 个原子轨道.
(3)它的价电子排布为 .
(1)此元素原子的电子总数是
(2)有
(3)它的价电子排布为
考点:元素电离能、电负性的含义及应用,原子核外电子排布
专题:原子组成与结构专题
分析:(1)某元素的原子序数为33,原子的电子总数等于原子序数,根据电子排布式判断未成对电子;
(2)该元素含有4个电子层,8个能级,18个轨道;
(3)根据该元素的外围电子排布式解答;
(2)该元素含有4个电子层,8个能级,18个轨道;
(3)根据该元素的外围电子排布式解答;
解答:
解:某元素的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,
(1)原子的电子总数等于原子序数,此元素原子序数为33,原子的电子总数是33,4p能级电子,3个单电子,有3个未成对电子,
故答案为:33;3;
(2)每个能级字母前的数字表示电子层数,所以该元素含有4个电子层,根据电子云的空间形状可知,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,所以该元素含有8个能级,18个轨道,
故答案为:4;8;18;
(3)它的外围电子排布式是4s24p3,所以它的价电子排布为4s24p3,
故答案为:4s24p3.
(1)原子的电子总数等于原子序数,此元素原子序数为33,原子的电子总数是33,4p能级电子,3个单电子,有3个未成对电子,
故答案为:33;3;
(2)每个能级字母前的数字表示电子层数,所以该元素含有4个电子层,根据电子云的空间形状可知,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,所以该元素含有8个能级,18个轨道,
故答案为:4;8;18;
(3)它的外围电子排布式是4s24p3,所以它的价电子排布为4s24p3,
故答案为:4s24p3.
点评:本题考查元素核外电子排布,比较基础,明确原子结构、构造原理是解答关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
根据下表所列电离能的数据,下列判断中错误的是.( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、在25℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
| B、48g O3 和O2混合气体所含的原子数目为3NA |
| C、1mol氦气所含的电子数目为4NA |
| D、2.7g金属铝变成铝离子时失去的电子数目为0.1NA |
下列有关实验的说法正确的是( )
| A、用NH3?H2O溶液能鉴别Al3+、Mg2+、Ag+、Cu2+ |
| B、配制一定物质的量浓度的稀H2SO4时,量筒量取浓溶液时若俯视读数,结果偏低 |
C、如图实验 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 ,关闭弹簧夹,用手捂住烧瓶,长导管下端有气泡冒出,说明气密性良好 |
| D、测定中和热时:取25 mL 10 mol/L的浓硫酸和25 mL 10 mol/L的NaOH溶液中和,测定反应放出的热量 |


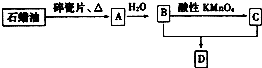 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物.A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略).