题目内容
下列元素中价电子排布不正确的是( )
| A、V:3d34s2 |
| B、Cr:3d44s2 |
| C、Ar:3s23p6 |
| D、Ni:3d84s2 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:基态电子排布遵循能量最低原理、泡利不相容原理和洪特规则,3d能级上的原子轨道处于半满时较为稳定,铬原子基态价电子排布式为3d54s1.
解答:
解:A、V基态原子价电子排布式为:3d34s2,符合基态电子排布规律,故A正确;
B、3d能级上的原子轨道处于半满时较为稳定,因此铬原子基态价电子排布式为3d54s1,故B错误;
C、Ar基态原子价电子排布式为:3s23p6,符合基态电子排布规律,故C正确;
D、Ni基态原子价电子排布式为:3d84s2,符合基态电子排布规律,故D正确;
故选B.
B、3d能级上的原子轨道处于半满时较为稳定,因此铬原子基态价电子排布式为3d54s1,故B错误;
C、Ar基态原子价电子排布式为:3s23p6,符合基态电子排布规律,故C正确;
D、Ni基态原子价电子排布式为:3d84s2,符合基态电子排布规律,故D正确;
故选B.
点评:本题考查核外电子排布,题目难度不大,易错选项是B,注意电子处于全满、半满、全空时最稳定.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
某基态原子第四电子层只有1个电子,该原子的第三电子层电子数可能有( )
| A、13 | B、16 |
| C、8~18 | D、18~32 |
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:下列判断不正确的是( )
| 实验编号 | c(HA)/mo1?L-1 | c(NaOH)/mo1?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | PH=9 |
| 乙 | c1 | 0.2 | PH=7 |
| A、甲反应后的溶液中:c(HA)+c(A-)=0.05mo1?L-1 |
| B、c1一定大于0.2 mo1?L-1 |
| C、0.1 mo1?L-1的HA溶液中由水电离出的c(H+)=1×l0-13mo1/L |
| D、乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
根据下表所列电离能的数据,下列判断中错误的是.( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A、元素X和Y可能是同周期元素 |
| B、元素X不可能是ⅡA族元素 |
| C、元素X与氯形成化合物时,化学式可能是XCl |
| D、元素Y在化学性质上与锡相似 |
 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.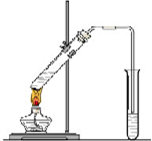 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用图所示的装置制取乙酸乙酯.回答下列问题


