题目内容
19.下列各组离子中,在pH=1的溶液中能大量共存且为无色透明溶液的是( )| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,pH=1溶液中存在大量氢离子,
A.碳酸根离子与氢离子反应;
B.四种离子之间不反应,都不与氢离子反应,且都是无色离子;
C.高锰酸根离子为有色离子;
D.四种离子之间不反应,都是无色离子,都不与氢离子反应.
解答 解:pH=1的溶液为酸性溶液,溶液中存在大量氢离子,溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.NH4+、NO3-、Ba2+、Cl-之间不反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故B正确;
C.MnO4-为有色离子,不满足溶液无色的条件,故C错误;
D.Na+、SO42-、Mg2+、Cl-之间不发生反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故D正确;
故选BD.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
9.主族元素X、Y、Z的简单离子核外电子排布相同,已知原子半径X>Y,离子半径Y>X,且Y和Z能形成离子化合物.由此判断关于三种元素说法正确的是( )
| A. | 原子序数不可能为Z>Y>X | B. | X可能是非金属元素 | ||
| C. | Z一定在Y的下一周期 | D. | Y不可能在Z的下一周期 |
7.在容积不变的密闭容器中,可逆反应:4A(g)+5B(g)?3C(g)+6D(g)△H<0,达到化学平衡状态的标志是( )
| A. | 气体密度不再发生变化 | |
| B. | A的物质的量浓度不再改变 | |
| C. | 容器内总压强不再改变 | |
| D. | 单位时间内消耗4nmolA,同时消耗5nmolB |
14.下列物质中,其水溶液能导电,但该物质属于非电解质的是( )
| A. | I2 | B. | NaCl | C. | CO2 | D. | 乙醇 |
4.下列溶液中的氯离子浓度最大的是( )
| A. | 60mL 1mol•L-1氯化钠溶液 | B. | 75mL 1mol•L-1氯化钙溶液 | ||
| C. | 60mL 3mol•L-1氯化钾溶液 | D. | 75mL 1.5mol•L-1氯化铁溶液 |
18.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作还原剂时,可能生成的产物是( )
| A. | N2 | B. | N2O3 | C. | NH3 | D. | NO2 |

 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$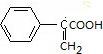 +Cu2O+2H2O
+Cu2O+2H2O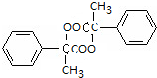
 已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.
已知:0.4mol液态N2H4与足量的液体双氧水反应,生成氮气和水蒸气,放出200.0kJ的热量.