题目内容
4.下列溶液中的氯离子浓度最大的是( )| A. | 60mL 1mol•L-1氯化钠溶液 | B. | 75mL 1mol•L-1氯化钙溶液 | ||
| C. | 60mL 3mol•L-1氯化钾溶液 | D. | 75mL 1.5mol•L-1氯化铁溶液 |
分析 电解质电离出的离子的物质的量浓度=溶质的物质的量浓度×溶质化学式中含有离子的个数,与溶液的体积无关,据此进行解答.
解答 解:A.60mL 1mol•L-1氯化钠溶液中氯离子的浓度为1mol/L;
B.75mL 1mol•L-1氯化钙溶液中氯离子的浓度为:1mol/L×2=2mol/L;
C.60mL 3mol•L-1氯化钾溶液中氯离子的浓度为3mol/L;
D.75mL 1.5mol•L-1氯化铁溶液中离子的浓度为:1.5mol/L×3=4.5mol/L;
根据分析可知,氯离子的浓度最大的为D,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意氯离子的物质的量浓度与溶液的体积无关,与溶质化学式、浓度有关.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.Ⅰ.在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)?2Z(g),已知将2molX 和1molY充入该容器中,反应在绝热条件下达到平衡时,Z 的物质的量为pmol.回答下列问题:
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.
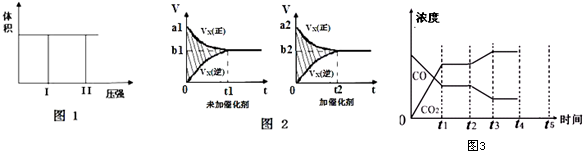
①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
A.2c1=c2=c3 B.2Q1=Q2=Q3 C.α1=α2=α3 D.α1+α2=1
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
(1)若把2molX 和1molY 充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的熵变△S< 0(填:“<,>,=”).该反应在低温(填:高温或低温)条件下能自发进行.
(2)该反应的v-t图象如图2中左图所示.若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示.以下说法正确的是②③⑤.

①a1>a2 ②b1<b2 ③t1>t2 ④图2中阴影部分面积更大 ⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如右上图所示.下列说法正确的是BD.
A.A、C 两点的反应速率:A>C
B.A、C 两点的气体密度:A<C
C.B、C 两点的气体的平均相对分子质量:B<C
D.由状态B 到状态A,可以用加热的方法
Ⅱ.(4)工业制取水煤气的过程中会伴随:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0的副反应,在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述反应,达到平衡后下列关系正确的是AD.
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
(5)图3表示上述反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是升高温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变).
15.下列物质在水溶液中的电离方程式错误的是( )
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
12.下列物质中属于电解质的是( )
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
| A. | ①② | B. | ①②⑤ | C. | ③④ | D. | ①⑤ |
19.下列各组离子中,在pH=1的溶液中能大量共存且为无色透明溶液的是( )
| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
16.纳米二氧化钛常用于化妆品、功能纤维等领域中,具有良好的紫外线屏蔽作用,下列分散系中的分散质的微粒直径与纳米二氧化钛具有相同数量级的是( )
| A. | NaCl溶液 | B. | Ca(OH)2悬浊液 | C. | Fe(OH)3胶体 | D. | 油漆等乳浊液 |
2.下列叙述正确的是( )
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 室温下若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1 | |
| C. | 室温下0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | NaHCO3溶液中:c(OH-)═c(H+)+c(H2CO3)+c(HCO3-) |
3.下列说法中正确的是( )
| A. | 活化分子具有的能量就是活化能 | |
| B. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 | |
| C. | 无论是吸热反应还是放热反应,升高温度都能增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
