题目内容
14.下列物质中,其水溶液能导电,但该物质属于非电解质的是( )| A. | I2 | B. | NaCl | C. | CO2 | D. | 乙醇 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答 解:A.因非电解质必须是化合物,而I2是单质,即I2既不是电解质也不是非电解质,故A错误;
B.因NaCl在水溶液或熔化状态下都能导电,则NaCl属于电解质,故B错误;
C.CO2的水溶液能导电,是因CO2和水反应生成碳酸,碳酸电离生成离子而导电,即发生电离不是二氧化碳本身,故二氧化碳属于非电解质,故C正确;
D.乙醇在水溶液中和熔融状态下均不导电,故不符合要求,故D错误.
故选C.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
4.下列说法正确的是( )
| A. | 蔗糖及其水解产物均能发生银镜反应 | |
| B. | 用酸性KMnO4溶液即可鉴别2-丁烯和正丁醛 | |
| C. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| D. | 用甘氨酸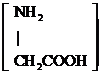 和丙氨酸 和丙氨酸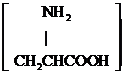 缩合最多可形成3种二肽 缩合最多可形成3种二肽 |
5.下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | KNO3(NaCl) | AgNO3溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
2.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 甲 | 乙 |
| 分子式 | C2H6O2 | C3H8O3 |
| 熔点/℃ | -11.5 | 17.9 |
| 沸点/℃ | 198 | 290 |
| 密度/g•cm-3 | 1.11 | 1.26 |
| 溶解性 | 易溶于水和酒精 | 易溶于水和酒精 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
19.下列各组离子中,在pH=1的溶液中能大量共存且为无色透明溶液的是( )
| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
3.一定温度下,下列溶液中的粒子浓度关系正确的是( )
| A. | 0.1mol•L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S) | |
| B. | 往氯化铵溶液中加水$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值变大 | |
| C. | 0.1mol•L-1的NaOH溶液与0.2mol•L-1的HA溶液等体积混合,所得溶液呈现碱性:c(Na+)>c(HA)c(A-)>c(OH-)>c(H+) | |
| D. | pH相等的①NH4Cl②NH4Al(SO4)2③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③ |
13.向某晶体的水溶液中加入Fe3+的溶液后,出现血红色,当滴加几滴KI溶液后,混合液变成无色.那么,由此得出下列的结论错误的是( )
| A. | 该晶体中一定含有SCN- | B. | Fe3+的氧化性比I2的氧化性强 | ||
| C. | Fe3+被I-还原 | D. | Fe2+是氧化产物 |
