题目内容
10.现有金属A、B和气体甲、乙、丙及物质C、D、F、F,它们之间的转化发生如下反应,(图中有些反应的产物和反应条件没有全部标出),其中B是地壳中含量最高的金属元素,反应④在野外经常用来焊接铁轨.④
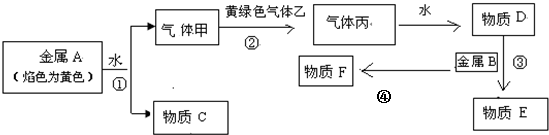
请回答下列问题:
(1)写出金属A与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(2)写出反应④化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)气体甲在黄绿色气体乙中燃烧的现象:燃烧,发出苍白色火焰,瓶口出现白雾.
(4)金属单质A投入到下列溶液中既有气体,又有沉淀出现的是C
A、氯化钠溶液 B、碳酸钠溶液 C、硫酸铜溶液 D、氯化铵溶液.
分析 金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,物质C为NaOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,氢气与氯气反应得气体丙为HCl,溶于水得到溶液D为盐酸溶液,盐酸与铝反应生成物质E为氯化铝,反应④在野外经常用来焊接铁轨,应为铝热反应,即氧化铁与铝高温条件下反应生成铁和氧化铝,据此答题.
解答 解:金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,物质C为NaOH,B是地壳中含量居第一的金属元素为Al,黄绿色气体乙为Cl2,氢气与氯气反应得气体丙为HCl,溶于水得到溶液D为盐酸溶液,盐酸与铝反应生成物质E为氯化铝,反应④在野外经常用来焊接铁轨,应为铝热反应,即氧化铁与铝高温条件下反应生成铁和氧化铝,
(1)钠与水反应的离子方程式为2Na+2H2O=2 Na++2OH-+H2↑,
故答案为:2Na+2H2O=2 Na++2OH-+H2↑;
(2)反应④为铝热反应,即氧化铁与铝高温条件下反应生成铁和氧化铝,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)甲为H2,甲在黄绿色气体乙中燃烧的现象为燃烧,发出苍白色火焰,瓶口出现白雾,
故答案为:燃烧,发出苍白色火焰,瓶口出现白雾;
(4)A、钠投入氯化钠溶液中,钠与水反应有气体产生,无沉淀;
B、钠投入碳酸钠溶液中,钠与水反应有气体产生,无沉淀;
C、钠投入硫酸铜溶液中,钠与水反应有气体产生,同时产生氢氧化钠,氢氧化钠与硫酸铜反应产生氢氧化铜沉淀;
D、钠投入氯化铵溶液中,钠与水反应有气体产生,同时产生氢氧化钠,氢氧化钠与氯化铵溶液反应产生氨气,无沉淀;
故选C.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,为高考常见题型,侧重于学生的分析能力的考查,正确推断物质的种类是解本题的关键,结合元素化合物的性质来分析解答即可,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| A. | 氯化钙是中性干燥剂,可用于实验室干燥氨气 | |
| B. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 | |
| C. | 常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 | |
| D. | 钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 |
| 物 质 | 试 剂 | |
| A | Na2SO4溶液(NaBr) | Cl2 |
| B | KNO3(NaCl) | AgNO3溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(HCl) | 饱和Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
| 物质 | 甲 | 乙 |
| 分子式 | C2H6O2 | C3H8O3 |
| 熔点/℃ | -11.5 | 17.9 |
| 沸点/℃ | 198 | 290 |
| 密度/g•cm-3 | 1.11 | 1.26 |
| 溶解性 | 易溶于水和酒精 | 易溶于水和酒精 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
| A. | 将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu | |
| B. | 盐酸与饱和的澄清石灰水反应:H++OH-══H2O | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+══Ca2++CO2↑+H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |

 .
.