题目内容
7.在容积不变的密闭容器中,可逆反应:4A(g)+5B(g)?3C(g)+6D(g)△H<0,达到化学平衡状态的标志是( )| A. | 气体密度不再发生变化 | |
| B. | A的物质的量浓度不再改变 | |
| C. | 容器内总压强不再改变 | |
| D. | 单位时间内消耗4nmolA,同时消耗5nmolB |
分析 达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答.
解答 解:A、该反应是一个反应前后气体的质量不改变的化学反应,容器的体积不变,所以混合气体的密度始终不变化,所以该反应此状态不一定达到平衡状态,故A错误;
B、根据平衡状态的概念可知,当各组分的物质的量浓度不再改变时即是平衡状态,此状态是平衡状态,故B正确;
C、该反应是一个反应前后气体的系数和相等的化学反应,容器内总压强不始终不改变,此状态不能说明反应达到平衡状态,故C错误;
D、单位时间内消耗4nmolA是正速率,同时消耗5nmolB为正速率,不能说明正逆反应速率相等,不是平衡状态,故D错误.
故选B.
点评 本题考查化学平衡状态的判断,题目难度不大,明确只有当反应前后改变的物理量不变时,可逆反应才达到平衡状态.

练习册系列答案
相关题目
17.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如下实验:
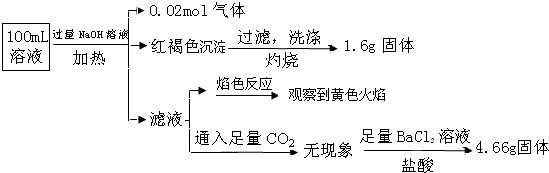
由此可知原溶液中( )

由此可知原溶液中( )
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
18.下列物质性质与应用对应关系不正确的是( )
| A. | 氯化钙是中性干燥剂,可用于实验室干燥氨气 | |
| B. | 二氧化氯具有强氧化性,可用于自来水的杀菌消毒 | |
| C. | 常温下,铝与浓硫酸发生钝化,可用铝槽车贮运浓硫酸 | |
| D. | 钠是一种具有强还原性的金属,可用于冶炼钛、锆、铌等金属 |
15.下列物质在水溶液中的电离方程式错误的是( )
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
2.现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 甲 | 乙 |
| 分子式 | C2H6O2 | C3H8O3 |
| 熔点/℃ | -11.5 | 17.9 |
| 沸点/℃ | 198 | 290 |
| 密度/g•cm-3 | 1.11 | 1.26 |
| 溶解性 | 易溶于水和酒精 | 易溶于水和酒精 |
| A. | 萃取法 | B. | 升华法 | C. | 蒸馏法 | D. | 分液法 |
12.下列物质中属于电解质的是( )
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
①氢氧化钾
②二氧化碳
③铜
④蔗糖
⑤碳酸钙.
| A. | ①② | B. | ①②⑤ | C. | ③④ | D. | ①⑤ |
19.下列各组离子中,在pH=1的溶液中能大量共存且为无色透明溶液的是( )
| A. | K+、CO32-、Na+、SO42- | B. | NH4+、NO3-、Ba2+、Cl- | ||
| C. | Na+、MnO4-、NO3-、K+ | D. | Na+、SO42-、Mg2+、Cl- |
16.纳米二氧化钛常用于化妆品、功能纤维等领域中,具有良好的紫外线屏蔽作用,下列分散系中的分散质的微粒直径与纳米二氧化钛具有相同数量级的是( )
| A. | NaCl溶液 | B. | Ca(OH)2悬浊液 | C. | Fe(OH)3胶体 | D. | 油漆等乳浊液 |
6.将一定量纯净的氨基甲酸铵固体置于密闭容器中,发生反应:NH2COONH4(s)?2NH3(g)+CO2(g).该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是( )

| A. | 该反应的△H>0 | |
| B. | NH3的体积分数不变时,该反应一定达到平衡状态 | |
| C. | A点对应状态的平衡常数K(A)=10-2.294 | |
| D. | 30℃时,B点对应状态的υ(正)<υ(逆) |