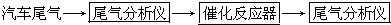题目内容
2.已知热化学方程式:C(s,石墨)→C(s,金刚石)-3.9kJ.下列有关说法正确的是( )| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |
分析 由热化学方程式可知,石墨转化为金刚石需要吸热,则石墨的能量低,以此来解答.
解答 解:A.石墨和金刚石完全燃烧,生成物相同,相同物质的量时后者放热多,因热量与物质的量成正比,故A错误;
B.石墨能量低,石墨稳定,故B错误;
C.由石墨转化为金刚石需要吸热,可知等量的金刚石储存的能量比石墨高,故C正确;
D.石墨在特定条件下转化为金刚石,需要合适的高温、高压,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、稳定性与能量关系为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
相关题目
12.向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
13.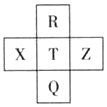 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
10.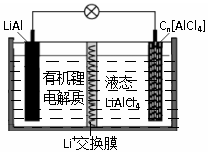 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )| A. | 充电时,Cn为阳极,电极反应为:Cn+AlCl4--e-═Cn[AlCl4] | |
| B. | 放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向LiAl极移动 | |
| C. | LiAl具有强氧化性,放电时作负极材料 | |
| D. | 电池中可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故该电池存在安全隐患 |
17.X、Y、Z、Q、W是原子序数依次增大的五种短周期主族元素.Y、Z同周期且相邻,X、Q与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:6,Q的单质与冷水反应缓慢、与热水反应产生气体.下列说法不正确的是( )
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
7.四种主族元素a、b、c、d分布在三个短周期中,其原子序数依次增大,b、d的简单离子具有相同电子层结构,d的简单离子半径是同周期主族元素中最小的,四种元素原子的最外层电子数之和为15,下列叙述错误的是( )
| A. | 气态氢化物的热稳定性:b<c | B. | 含d元素的盐溶液可能呈碱性 | ||
| C. | 原子半径:d>c>b>a | D. | a、b和c三种元素能形成离子化合物 |
3.一种锂钢可充电电池的结构如图所示,下列说法正确的是( )
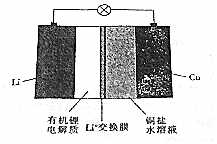

| A. | 放电时,正极上有金属锂析出 | |
| B. | 充电时,阳极区溶液中c(Cu2+)增大 | |
| C. | 放电时,负极区溶液中c(OH-)增大 | |
| D. | 充电时,阴极的电极反应式为Cu2++2e-═Cu |
4.下列有关物质的性质与用途具有对应关系的是( )
| A. | 浓H2SO4具有氧化性,可用作SO2的干燥剂 | |
| B. | H2O2能使蛋白质变性,可用作医疗的消毒剂 | |
| C. | C2H4气体具有可燃性,可用作果实的催熟剂 | |
| D. | Fe2O3水溶液显弱酸性,可用作H2S的脱除剂 |
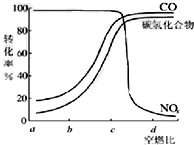 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.