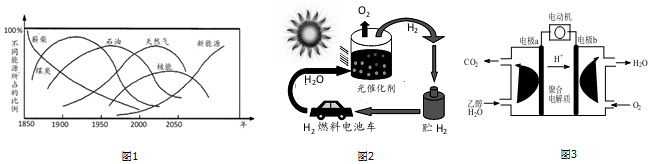
题目内容
3.一种锂钢可充电电池的结构如图所示,下列说法正确的是( )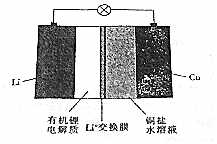
| A. | 放电时,正极上有金属锂析出 | |
| B. | 充电时,阳极区溶液中c(Cu2+)增大 | |
| C. | 放电时,负极区溶液中c(OH-)增大 | |
| D. | 充电时,阴极的电极反应式为Cu2++2e-═Cu |
分析 Li比Cu活泼,形成原电池时,Li为负极,被氧化,发生Li-e-=Li+,Cu为正极,发生还原反应,电极方程式为Cu2++2e-═Cu,充电时,阳极发生氧化反应,阴极发生还原反应,与原电池反应相反,以此解答该题.
解答 解:A.放电时,正极发生还原反应,电极方程式为Cu2++2e-═Cu,析出铜,故A错误;
B.充电时,阳极发生氧化反应,发生Cu-2e-=Cu2+,则c(Cu2+)增大,故B正确;
C.负极发生发生Li-e-=Li+,且为非水电解质,故C错误;
D.充电时,阴极发生Li++e-═Li,故D错误.
故选B.
点评 本题考查了原电池和电解池原理,为高频考点,侧重考查学生的分析能力,明确正负极、阴阳极上得失电子及电极反应是解本题关键,难点是电极反应式的书写,注意原电池正负极上发生的反应为电解池阳极、阴极上发生反应的逆反应,难度中等.

练习册系列答案
相关题目
1.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到.下列有关甲、乙的说法正确的是( )
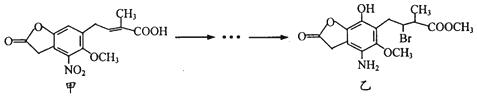

| A. | 甲的分子式为C14H14NO7 | |
| B. | 甲、乙中各有1个手性碳原子 | |
| C. | 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 | |
| D. | 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应 |
2.已知热化学方程式:C(s,石墨)→C(s,金刚石)-3.9kJ.下列有关说法正确的是( )
| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |
8.已知W、X、Y、Z为短周期元素,它们的原子半径依次增大,W和Z、X和Y分别同主族,Y、Z同周期.Z能与X形成两种常见的离子化合物,离子个数比均为2:1.下列说法错误的是( )
| A. | Z、Y、X、W的原子序数依次减小 | |
| B. | W与X可形成既含极性共价键又含非极性共价键的化合物 | |
| C. | Z的最高价氧化物对应的水化物是短周期元素形成的最强碱 | |
| D. | X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
15.下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 将0.1mol•L-1MgSO4溶液滴入 过量NaOH溶液,再滴加几滴0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
12.用下列装置在实验室中进行二氧化硫的制取、检验、收集和尾气处理,不能达到相应实验目的是( )
| A. | 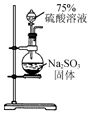 用装置制取二氧化硫 | B. | 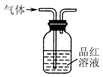 用装置检验二氧化硫的漂白性 | ||
| C. | 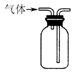 用装置收集二氧化硫 | D. | 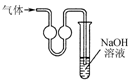 用装置进行尾气处理 |
13.下列物质属于原子晶体的是( )
| A. | HCl | B. | He | C. | Si | D. | NaCl |