题目内容
13.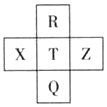 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
分析 R单质在暗处与H2剧烈化合并发生爆炸,则R为F,结合元素在周期表的位置可知,T为Cl,Q为Br,X为X,Z为Ar,
A.氯气与水反应中Cl元素的化合价升高也降低;
B.质子数等于电子数,R、Q的质子数分别为9、35;
C.非金属性Cl>S;
D.稀有气体最外层为8电子稳定结构.
解答 解:R单质在暗处与H2剧烈化合并发生爆炸,则R为F,结合元素在周期表的位置可知,T为Cl,Q为Br,X为X,Z为Ar,
A.氯气与水反应中Cl元素的化合价升高也降低,则T的单质在化学反应中可表现氧化性、还原性,故A错误;
B.质子数等于电子数,R、Q的质子数分别为9、35,则R与Q的电子数相差26,故B错误;
C.非金属性Cl>S,则T形成的最高价含氧酸的酸性一定比X形成的最高价含氧酸的酸性强,而酸性硫酸>HClO,故C错误;
D.稀有气体最外层为8电子稳定结构,则在这五种元素中Z的化学性质最稳定,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
4.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |
1.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到.下列有关甲、乙的说法正确的是( )
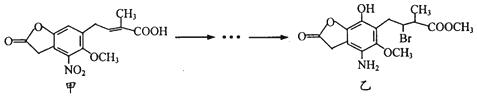

| A. | 甲的分子式为C14H14NO7 | |
| B. | 甲、乙中各有1个手性碳原子 | |
| C. | 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 | |
| D. | 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应 |
8.化学与生活有密切联系,下列说法正确的是( )
| A. | 酸雨易导致土壤胶粒吸附H+使土壤酸化,影响铵态氮肥和钾肥的有效利用 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 |
18.为探究元素性质递变规律,设计如下实验.
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选).
A.剧烈反应,迅速产生大量无色气体.
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
C.反应不十分剧烈;产生无色气体.
D.有气体产生,溶液变成浅红色.
(2)实验④:向1mL 1mol/L AlCl3溶液中滴加2mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失.
请用离子方程式解释该实验现象:Al3++3OH-═Al(OH)3↓;、Al(OH)3+OH-═AlO2-+2H2O
(3)实验⑤:在试管中加入3~5mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡.观察试管中出现白色凝胶.相应化学方程式:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4,证明酸性:H2SO4>H2SiO3(用化学式表示).
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水.观察试管中出现黄色沉淀.相应离子方程式:S2-+Cl2═S↓+2Cl-,证明氧化性:Cl2>S(用化学式表示).
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐减弱 (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐增强(选填“增强”或“减弱”).
(1)填写各实验步骤对应的实验现象(选填相应序号;不重复选).
| 实验序号 | 实验步骤 | 实验现象 |
| ① | 将一小块金属钠放入滴有酚酞溶液的冷水中. | B |
| ② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾. | D |
| ③ | 将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中. | A |
| ④ | 将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中. | C |
B.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色.
C.反应不十分剧烈;产生无色气体.
D.有气体产生,溶液变成浅红色.
(2)实验④:向1mL 1mol/L AlCl3溶液中滴加2mol/L NaOH溶液至过量,观察生成白色胶状沉淀,继而沉淀消失.
请用离子方程式解释该实验现象:Al3++3OH-═Al(OH)3↓;、Al(OH)3+OH-═AlO2-+2H2O
(3)实验⑤:在试管中加入3~5mL Na2SiO3溶液,逐滴加入稀硫酸,边加边振荡.观察试管中出现白色凝胶.相应化学方程式:H2SO4+Na2SiO3═H2SiO3(胶体)+Na2SiO4,证明酸性:H2SO4>H2SiO3(用化学式表示).
(4)实验⑥:向新制得的Na2S溶液中滴加新制的氯水.观察试管中出现黄色沉淀.相应离子方程式:S2-+Cl2═S↓+2Cl-,证明氧化性:Cl2>S(用化学式表示).
通过以上实验和讨论,推断钠、镁、铝的金属性逐渐减弱 (选填“增强”或“减弱”),硅、硫、氯的非金属性逐渐增强(选填“增强”或“减弱”).
5.下列说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
2.已知热化学方程式:C(s,石墨)→C(s,金刚石)-3.9kJ.下列有关说法正确的是( )
| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |
15.下列实验中,对应的现象以及解释或结论都正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 将0.1mol•L-1MgSO4溶液滴入 过量NaOH溶液,再滴加几滴0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |