题目内容
12.向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
分析 向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,溶液中含Fe2+、Al3+、Fe3+,
A.过量H2S与Fe3+发生氧化还原反应;
B.过量氨气,不能与氢氧化铝反应;
C.过量NaC1O溶液,与Al3+不反应;
D.加入过量NaOH溶液,不存在SiO32-.
解答 解:向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,溶液中含Fe2+、Al3+、Fe3+,
A.过量H2S与Fe3+发生氧化还原反应,则溶液中含H+、Fe2+、Al3+、SO42-,故A正确;
B.过量氨气,不能与氢氧化铝反应,则溶液中不能大量存在A1O2-,故B错误;
C.过量NaC1O溶液,与Al3+不反应,溶液中应含Al3+,故C错误;
D.因二氧化硅与硫酸不反应,浸取液加入过量NaOH溶液,不存在SiO32-,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
2. 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s)△H=-akJ•mol-1
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
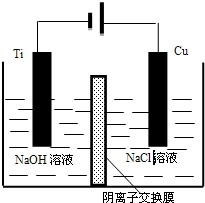
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
下列叙述正确的是cd(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-bkJ•mol-1
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-ckJ•mol-1
则方法I发生的反应:2Cu O(s)+C(s)=Cu2O(s)+CO(g);△H=2c-a-bkJ•mol-1.
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:若温度不当,会生成Cu.
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑.
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式
并说明该装置制备Cu2O的原理阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O.
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g)$?_{Cu_{2}O}^{光照}$2H2(g)+O2(g)△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如表所示.
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10-5mol•L-1•min-1
c.实验②比实验①所用的Cu2O催化效率高
d. 实验①、②、③的化学平衡常数的关系:K1=K2<K3.
3.(D2O)是重要的核工业原料,下列说法错误的是( )
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
20.下列实验能达到目的是( )
| A. | 用KI溶液除去FeCl2溶液中的Fe3+ | B. | 用饱和NaHCO3溶液除去Cl2中的HC1 | ||
| C. | 用金属钠鉴别1一丁醇和2一丁醇 | D. | 用溴水鉴别苯和己烯 |
7.我国在航天、军事等领域的发展得到世界瞩目,与化学有着密切联系.下列说法正确的是( )
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “神舟十一号”宇宙飞船返回舱外表面主要是耐高温的新型无机非金属材料 | |
| C. | “天宮一号”是中国第一个空间实验室,其太阳能电池板的主要材料是二氧化硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
17.下列有关实验原理或操作不正确的是( )
| A. | 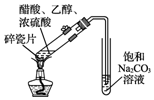 用图装置制取少量乙酸乙酯 | |
| B. | 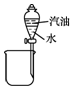 用图装置分离汽油和水 | |
| C. | 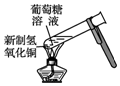 用图装置验证葡萄糖的还原性 | |
| D. | 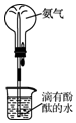 用图装置验证氨气的溶解性和氨水的碱性 |
4.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | l8gNH4+中所含的电子数为11NA | |
| B. | 常温常压下,3.4gH2O2含有极性键的数目为0.2NA | |
| C. | 常温下,1L pH=1的H2SO4溶液中含有的H+的数目为0.2NA | |
| D. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA |
1.化合物乙是一种治疗神经类疾病的药物,可由化合物甲经多步反应得到.下列有关甲、乙的说法正确的是( )
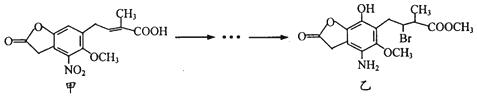

| A. | 甲的分子式为C14H14NO7 | |
| B. | 甲、乙中各有1个手性碳原子 | |
| C. | 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 | |
| D. | 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应 |
2.已知热化学方程式:C(s,石墨)→C(s,金刚石)-3.9kJ.下列有关说法正确的是( )
| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |