题目内容
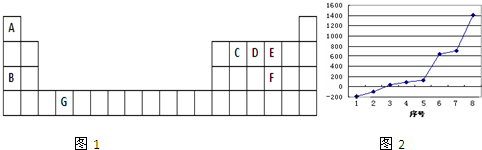
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如下表:
(1)Y在周期表的位置为 .
(2)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式 .
(3)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是 (填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(4)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.化合物QX的制备可用Q的氧化物、焦炭和X的单质在1600~1750℃反应生成,已知每生成1mol QX,消耗1.5mol碳,写出该反应的化学方程式 .
(5)X、Y组成的一种无色气体遇空气变为红棕色.同温同压下,将该无色气体与氧气按一定体积比同时通入足量NaOH溶液中完全吸收,经测定,溶液中 NO3-、NO2-的物质的量比为1:3,写出该反应的离子方程式 .
| X | 是植物生长的营养元素之一,也是蛋白质的重要组成元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(2)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式
(3)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(4)化合物QX导热性好,热膨胀系数小,是良好的耐热冲击材料.化合物QX的制备可用Q的氧化物、焦炭和X的单质在1600~1750℃反应生成,已知每生成1mol QX,消耗1.5mol碳,写出该反应的化学方程式
(5)X、Y组成的一种无色气体遇空气变为红棕色.同温同压下,将该无色气体与氧气按一定体积比同时通入足量NaOH溶液中完全吸收,经测定,溶液中 NO3-、NO2-的物质的量比为1:3,写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大,则Z为Na元素;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al元素;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,处于ⅦA,则M为Cl元素,以此来解答.
解答:
解:X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.X是动植物生长不可缺少的元素,是蛋白质的重要成分,则X为N元素;Y元素在地壳中含量居第一位,则Y为O元素;Z是短周期中其原子半径最大,则Z为Na元素;Q是生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备,则Q为Al元素;M是海水中大量富集的元素之一,其最高正化合价与负价的代数和为6,处于ⅦA,则M为Cl元素,
(1)Y为O元素,处于周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该气体为氨气,分子中氮原子与氢原子之间形成1对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(3)a.同周期自左而右原子半径减小,故原子半径:Rb>I,故a正确;
b.RbCl属于离子化合物,含有离子键,不含共价键,故b错误;
c.非金属性Cl>I,故气态氢化物热稳定性:Cl>I,故c正确;
d.氢氧化铷是强碱,高氯酸是强酸,氢氧化铝是两性氢氧化物,与氢氧化铷、高氯酸反应生成相应的盐与水,氢氧化铷、高氯酸发生中和反应,故d正确;
故答案为:acd;
(4)Al的氧化物、焦炭和氮气在1600~1750℃生成AlN,每生成1molAlN,消耗18g碳,需要碳的物质的量=
=1.5mol,根据电子转移守恒可知C元素反应后化合价为
=2,故生成CO,则化学方程式为Al2O3+3C+N2
2AlN+3CO,
故答案为:Al2O3+3C+N2
2AlN+3CO;
(5)X、Y组成的一种无色气体遇空气变为红棕色.该无色气体为NO,将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,氮元素被氧化,生成硝酸盐、亚硝酸盐,令生成的被氧化为硝酸盐、亚硝酸盐的氨气的体积分别为xL、yL,则:x+y=40,根据电子转移守恒有:3x+y=15×4,联立解得x=10,y=30,故生成的硝酸盐、亚硝酸盐物质的量之比=10L:30L=1:3,反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
(1)Y为O元素,处于周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,该气体为氨气,分子中氮原子与氢原子之间形成1对共用电子对,电子式为
 ,故答案为:
,故答案为: ;
;(3)a.同周期自左而右原子半径减小,故原子半径:Rb>I,故a正确;
b.RbCl属于离子化合物,含有离子键,不含共价键,故b错误;
c.非金属性Cl>I,故气态氢化物热稳定性:Cl>I,故c正确;
d.氢氧化铷是强碱,高氯酸是强酸,氢氧化铝是两性氢氧化物,与氢氧化铷、高氯酸反应生成相应的盐与水,氢氧化铷、高氯酸发生中和反应,故d正确;
故答案为:acd;
(4)Al的氧化物、焦炭和氮气在1600~1750℃生成AlN,每生成1molAlN,消耗18g碳,需要碳的物质的量=
| 18g |
| 12g/mol |
| 1mol×3 |
| 1.5mol |
| ||
故答案为:Al2O3+3C+N2
| ||
(5)X、Y组成的一种无色气体遇空气变为红棕色.该无色气体为NO,将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐,氮元素被氧化,生成硝酸盐、亚硝酸盐,令生成的被氧化为硝酸盐、亚硝酸盐的氨气的体积分别为xL、yL,则:x+y=40,根据电子转移守恒有:3x+y=15×4,联立解得x=10,y=30,故生成的硝酸盐、亚硝酸盐物质的量之比=10L:30L=1:3,反应离子方程式为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O,
故答案为:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
点评:本题考查位置、结构及性质的应用,为高频考点,把握原子结构及元素化合物性质为解答的关键,侧重分析与推断能力的考查,(5)中注意利用电子转移守恒确定硝酸盐、亚硝酸盐的物质的量之比,综合性较强,题目难度不大.

练习册系列答案
相关题目
标准状况下与11.2L CO2所含原子个数相同的N2的质量是( )
| A、14g | B、7g |
| C、21g | D、28g |

 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: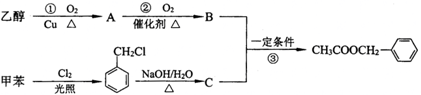
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: