题目内容
下表1是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
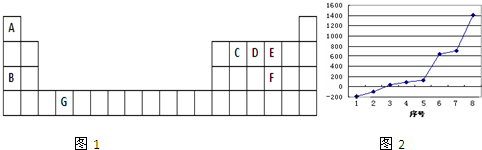
试回答下列问题:
(1)请写出元素G的基态原子电子排布式 .
(2)C的一种气态氢化物可作水果的催熟剂,该氢化物分子中σ键与π键的数目之比为 .
(3)C、D、E三种元素第一电离能由大到小的顺序为 (填元素符号),其中电负性 最大的是 (填元素符号).
(4)写出B与E形成的化合物B2E2的电子式 ,指出该化合物中的化学键 .
(5)比较沸点:A2E A2F(填“大于”、“小于”),原因是: .
(6)第三周期8种元素按单质熔点(℃)高低的顺序如图2,其中序号“8”代表 (填元素符号).

试回答下列问题:
(1)请写出元素G的基态原子电子排布式
(2)C的一种气态氢化物可作水果的催熟剂,该氢化物分子中σ键与π键的数目之比为
(3)C、D、E三种元素第一电离能由大到小的顺序为
(4)写出B与E形成的化合物B2E2的电子式
(5)比较沸点:A2E
(6)第三周期8种元素按单质熔点(℃)高低的顺序如图2,其中序号“8”代表
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据图1及元素周期表结构可知,A为H元素、B为Na元素、C为C元素、D为N元素、E为O元素、F为S元素、G为Ti元素,
(1)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、泡利原理和洪特规则,Ti元素原子的核外电子数为22,根据核外电子排布规律书写Ti的基态原子电子排布式;
(2)该氢化物为C2H4,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,故分子中有5个σ键、1个π键,分子中的σ键与π键的键数之比为5:1;
(3)同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;同周期随原子序数增大电负性增大;
(4)化合物B2E2为Na2O2,过氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,过氧化钠中存在离子键和非极性共价键;
(5)水分子中有氢键,氢键的作用力大于范德华力,导致熔沸点变大,硫化氢分子间没有氢键,所以水的沸点比硫化氢的沸点高;
(6)硅单质属于原子晶体,原子晶体熔沸点较高,据此进行解答.
(1)处于最低能量的原子叫做基态原子,基态电子排布遵循能量最低原理、泡利原理和洪特规则,Ti元素原子的核外电子数为22,根据核外电子排布规律书写Ti的基态原子电子排布式;
(2)该氢化物为C2H4,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,故分子中有5个σ键、1个π键,分子中的σ键与π键的键数之比为5:1;
(3)同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;同周期随原子序数增大电负性增大;
(4)化合物B2E2为Na2O2,过氧化钠属于离子化合物,电子式中需要标出阴阳离子所带电荷,过氧化钠中存在离子键和非极性共价键;
(5)水分子中有氢键,氢键的作用力大于范德华力,导致熔沸点变大,硫化氢分子间没有氢键,所以水的沸点比硫化氢的沸点高;
(6)硅单质属于原子晶体,原子晶体熔沸点较高,据此进行解答.
解答:
解:根据图1及元素周期表结构可知,A为H元素、B为Na元素、C为C元素、D为N元素、E为O元素、F为S元素、G为Ti元素,
(1)Ti元素为22号元素,原子核外有22个电子,所以核外电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(2)C为C元素,碳的一种氢化物可作水果的催熟剂,该氢化物为C2H4,C2H4分子结构式为CH2=CH2,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,σ键与π键的数目之比为5:1,
故答案为:5:1;
(3)C为C元素、D为N元素、E为O元素,同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能大小为:N>O>C;同周期随原子序数增大电负性增大,故电负性大小为:O>N>C,电负性最大的为O元素,
故答案为:N>O>C;O;
(4)B为Na元素、E为O元素,B与E形成的化合物B2E2为Na2O2,过氧化钠属于离子化合物,过氧化钠的电子式为: ,过氧化钠中含有离子键和非极性共价键,
,过氧化钠中含有离子键和非极性共价键,
故答案为: ;离子键、非极性共价键;
;离子键、非极性共价键;
(5)A为H元素、E为O元素、F为S元素,水分子之间存在氢键,导致水分子之间作用力增强,故同主族氢化物中中水的沸点最高,则沸点:H2O>H2S,
故答案为:>;H2O分子间存在氢键而H2S分子间不能形成氢键;
(6)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si,
故答案为:Si.
(1)Ti元素为22号元素,原子核外有22个电子,所以核外电子排布式为:1s22s22p63s23p63d24s2,
故答案为:1s22s22p63s23p63d24s2;
(2)C为C元素,碳的一种氢化物可作水果的催熟剂,该氢化物为C2H4,C2H4分子结构式为CH2=CH2,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,σ键与π键的数目之比为5:1,
故答案为:5:1;
(3)C为C元素、D为N元素、E为O元素,同周期自左而右第一电离能呈增大趋势,但N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能大小为:N>O>C;同周期随原子序数增大电负性增大,故电负性大小为:O>N>C,电负性最大的为O元素,
故答案为:N>O>C;O;
(4)B为Na元素、E为O元素,B与E形成的化合物B2E2为Na2O2,过氧化钠属于离子化合物,过氧化钠的电子式为:
 ,过氧化钠中含有离子键和非极性共价键,
,过氧化钠中含有离子键和非极性共价键,故答案为:
 ;离子键、非极性共价键;
;离子键、非极性共价键;(5)A为H元素、E为O元素、F为S元素,水分子之间存在氢键,导致水分子之间作用力增强,故同主族氢化物中中水的沸点最高,则沸点:H2O>H2S,
故答案为:>;H2O分子间存在氢键而H2S分子间不能形成氢键;
(6)第三周期8种元素的单质中只有Si为原子晶体,熔沸点最大,由图可知序号“8”代表的为Si,
故答案为:Si.
点评:本题考查了位置结构与性质的关系,题目难度中等,试题知识点较大、综合性较强,正确判断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,(3)中注意氮元素的第一电离能比同一周期邻近元素的大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
胶体分散系与其它分散系的本质差别是( )
| A、分散质粒子是否带电 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质直径大小 |
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
| A、1.14g | B、1.6g |
| C、2.82g | D、4.36g |
将氯化钠、乙醇、碘分别从以下三种混合物中分离出来,①食盐水②乙醇溶液③碘水( )
| A、蒸馏、萃取、蒸发 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸发、蒸馏、萃取 |



