题目内容
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子).
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.已知:金属离子氢氧化物沉淀所需pH是
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A.MgO B.Na2CO3 C.蒸馏水
(2)Fe2+与H2O2溶液反应的离子方程式为
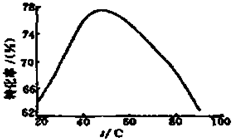
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,试剂不能引入新的杂质分析;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,依据氧化还原反应的电荷守恒和电子守恒些离子方程式;
(3)①步骤III中制备氢氧化镁反应的离子方程式是氨水沉淀镁离子,注意一水合氨是弱电解质;
②根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;
③温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,依据氧化还原反应的电荷守恒和电子守恒些离子方程式;
(3)①步骤III中制备氢氧化镁反应的离子方程式是氨水沉淀镁离子,注意一水合氨是弱电解质;
②根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;
③温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
解答:
解:(1)步骤II中,可用于调节溶液pH至7~8的目的是和酸反应提高溶液pH,使Fe3+、Al3+等杂质离子沉淀分离除去,
A、加入氧化镁和酸反应能提高溶液PH,生成镁离子,不加入杂质离子,可选;
B、加入碳酸钠能调节溶液PH但假如了钠离子,引入杂质,故不选;
C、蒸馏水对提高溶液pH不好,故不选;
故答案为:A;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)①氨水沉淀镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+;
②根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;故答案为:吸热;
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降,
故答案为:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
A、加入氧化镁和酸反应能提高溶液PH,生成镁离子,不加入杂质离子,可选;
B、加入碳酸钠能调节溶液PH但假如了钠离子,引入杂质,故不选;
C、蒸馏水对提高溶液pH不好,故不选;
故答案为:A;
(2)Fe2+与H2O2溶液反应亚铁离子被过氧化氢氧化为三价铁离子便于完全沉淀,过氧化氢被还原为水,反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)①氨水沉淀镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3?H2O═Mg(OH)2↓+2NH4+;
②根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;故答案为:吸热;
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降,
故答案为:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
点评:本题考查了难溶物沉淀溶解平衡的分析判断,离子沉淀的条件选择,化学平衡的影响因素,离子方程式的书写,沉淀转化的原理应用,题目综合性较强.

练习册系列答案
相关题目
含MgCl2、KCl、Na2SO4三种溶质的混合液中,已知其中含Cl-1.5mol,K+和Na+共1.5mol,Mg2+为0.5mol,则SO42-的物质的量为( )
| A、1 mol |
| B、0.5 mol |
| C、0.25 mol |
| D、0.15 mol |
下列有关晶体的说法中正确的是( )
| A、金属晶体和离子晶体都能导电 |
| B、冰、“可燃冰”、干冰都具有分子密堆积特征 |
| C、金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 |
| D、金属晶体和离子晶体中分别存在金属键和离子键,很难断裂,都具有延展性 |
将2mol SO2和2mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)?2SO3(g),平衡时SO3为W mol.相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
胶体分散系与其它分散系的本质差别是( )
| A、分散质粒子是否带电 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质直径大小 |
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.