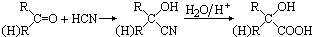题目内容
已知A、B、C、D、E、F是元素周期表中前四周期元素,其原子序数依次增大.A、B同周期其中A的基态原子的最外层有3个未成对电子,次外层有2个电子;B原子最外层电子数是内层电子数的3倍;C是同周期中第一电离能最小的元素;D的离子是同周期是半径最小的;E是海水中含量最多的元素(H、O元素除外);F位于第四周期第ⅥB族.
请回答下列问题:
(1)F元素原子基态时的电子排布式为 ;
(2)B、C按原子个数比1:1形成的化合物的电子为 ;该化合物与水反应的生成物G能与D的最高价氧化物的水化物反应写出其离子方程式 ;
(3)A、B两元素的第一电离能大小为: (用元素符号,下同),A、B两元素分别形成的氢化物的稳定性为: ;
(4)元素A与元素E可以形成化合物AE3,根据价层电子对互斥理论可以判断AE3的空间构型为 ,AE3分子中A原子的杂化方式为 杂化;
(5)在酸性条件下F2B72-能将乙醇氧化成乙酸,F转化为灰绿色的+3价离子,写出该反应的离子方程式 .
请回答下列问题:
(1)F元素原子基态时的电子排布式为
(2)B、C按原子个数比1:1形成的化合物的电子为
(3)A、B两元素的第一电离能大小为:
(4)元素A与元素E可以形成化合物AE3,根据价层电子对互斥理论可以判断AE3的空间构型为
(5)在酸性条件下F2B72-能将乙醇氧化成乙酸,F转化为灰绿色的+3价离子,写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,A、B同周期其中A的基态原子的最外层有3个未成对电子,次外层有2个电子,电子排布式为1s22s22p3,则A、B两元素的第一电离能大小为;B原子最外层电子数是内层电子数的3倍,电子排布式为1s22s22p4,则B为氧元素,可推知外围电子排布为ns2np5,C是同周期中第一电离能最小的元素,知C为Na元素;D的离子是同周期是半径最小的,则D为Al;E是海水中含量最多的元素(H、O元素除外),则E为氯元素;F位于第四周期第ⅥB族,则F为铬元素,据此解答.
解答:
解:A、B、C、D、E、F均为周期表中前四周期元素,其原子序数依次增大,A、B同周期其中A的基态原子的最外层有3个未成对电子,次外层有2个电子,电子排布式为1s22s22p3,则A为氮元素;B原子最外层电子数是内层电子数的3倍,电子排布式为1s22s22p4,则B为氧元素,可推知外围电子排布为ns2np5,C是同周期中第一电离能最小的元素,知C为Na元素;D的离子是同周期是半径最小的,则D为Al;E是海水中含量最多的元素(H、O元素除外),则E为氯元素;F位于第四周期第ⅥB族,则F为铬元素.
(1)F元素为Cr,Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)Na与O形成原子个数比为1:1的化合物为Na2O2,属于离子化合物,由钠离子与过氧根离子构成,其电子式为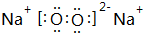 ,该化合物与水反应的生成物NaOH能与D的最高价氧化物的水化物Al(OH)3反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
,该化合物与水反应的生成物NaOH能与D的最高价氧化物的水化物Al(OH)3反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为: ;Al(OH)3+OH-=AlO2-+2H2O;
;Al(OH)3+OH-=AlO2-+2H2O;
(3)A为氮元素,价电子排布为2s22p3,B为氧元素,价电子排布为2s22p4,前者2p能级电子是半充满稳定结构,故第一电离能N>O;非金属性N<O,故两元素分别形成的氢化物的稳定性为NH3<H2O,故答案为:N>O;NH3<H2O;
(4)元素A与元素E可以形成化合物为NCl3,价层电子对数为4,其中有1对孤电子对,根据互斥理论可以判断其空间构型为三角锥形;NCl3分子中N原子的杂化方式为sp3杂化,故答案为:三角锥形;sp3;
(5)在酸性条件下Cr2O72-能将乙醇氧化成乙酸,Cr转化为灰绿色的+3价离子,根据电子守恒和质量守恒可写出该反应的离子方程式为3C2H5OH+2Cr2O72-+16H+=3CH3COOH+4Cr3++11H2O,故答案为:3C2H5OH+2Cr2O72-+16H+=3CH3COOH+4Cr3++11H2O.
(1)F元素为Cr,Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)Na与O形成原子个数比为1:1的化合物为Na2O2,属于离子化合物,由钠离子与过氧根离子构成,其电子式为
 ,该化合物与水反应的生成物NaOH能与D的最高价氧化物的水化物Al(OH)3反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
,该化合物与水反应的生成物NaOH能与D的最高价氧化物的水化物Al(OH)3反应,其离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:
 ;Al(OH)3+OH-=AlO2-+2H2O;
;Al(OH)3+OH-=AlO2-+2H2O;(3)A为氮元素,价电子排布为2s22p3,B为氧元素,价电子排布为2s22p4,前者2p能级电子是半充满稳定结构,故第一电离能N>O;非金属性N<O,故两元素分别形成的氢化物的稳定性为NH3<H2O,故答案为:N>O;NH3<H2O;
(4)元素A与元素E可以形成化合物为NCl3,价层电子对数为4,其中有1对孤电子对,根据互斥理论可以判断其空间构型为三角锥形;NCl3分子中N原子的杂化方式为sp3杂化,故答案为:三角锥形;sp3;
(5)在酸性条件下Cr2O72-能将乙醇氧化成乙酸,Cr转化为灰绿色的+3价离子,根据电子守恒和质量守恒可写出该反应的离子方程式为3C2H5OH+2Cr2O72-+16H+=3CH3COOH+4Cr3++11H2O,故答案为:3C2H5OH+2Cr2O72-+16H+=3CH3COOH+4Cr3++11H2O.
点评:本题考查物质结构与性质,推断元素是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、2.24L氨气中氨分子数目为0.2NA |
| B、1mol甲基中电子数目为9NA |
| C、1L0.1mol?L-1NaHCO3溶液中氧原子数目为0.3NA |
| D、7.8gNa2O2与足量H2O反应,转移电子数目为0.2NA |
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是( )
| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、离子Y2-和Z3+的核外电子数和电子层数均相同 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
向200ml 0.1mol/L的FeCl2溶液中加入适量的NaOH溶液,使Fe2+恰好完全沉淀,过滤,小心加热沉淀,直到水分蒸干,再灼烧到质量不再变化,此时固体的质量为( )
| A、1.14g | B、1.6g |
| C、2.82g | D、4.36g |

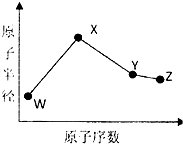 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.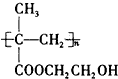 制成超薄镜片,其合成路线可以是:
制成超薄镜片,其合成路线可以是: