题目内容
为探究Cl2、漂白粉的制备及有关性质,某兴趣小组设计并进行了以下实验探究.请回答以下问题:
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→ 、 → 、 → ;其中广口瓶Ⅱ中的试剂为 .

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式 ;
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2.请设计实验,探究该样品中除CaCl2外还含有的其他固体物质.
①提出合理假设.
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有 ;
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3.
②设计实验方案,进行实验.请在下表中写出实验步骤、预期现象和结论.
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1mol?L-1 HCl溶液、新制澄清石灰水.(提示:不必检验Ca2+和Cl-.)
(1)实验室拟用下列装置制备干燥纯净的氯气,请按照气体从左向右流动的方向将仪器进行连接:H→

(2)写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式
(3)实验室有一瓶密封不严的漂白粉样品,其中肯定存在CaCl2.请设计实验,探究该样品中除CaCl2外还含有的其他固体物质.
①提出合理假设.
假设1:该漂白粉未变质,还含有Ca(ClO)2
假设2:该漂白粉全部变质,还含有
假设3:该漂白粉部分变质,还含有Ca(ClO)2和CaCO3.
②设计实验方案,进行实验.请在下表中写出实验步骤、预期现象和结论.
限选用的仪器和药品:试管、滴管、带导管的单孔塞、蒸馏水、自来水、品红溶液、1mol?L-1 HCl溶液、新制澄清石灰水.(提示:不必检验Ca2+和Cl-.)
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取少量上述漂白粉于试管中,先加入 | 若 若 |
| 步骤2 | 已确定漂白粉变质,则另取少量上述漂白粉于试管中,先加入适量1mol?L-1 HCl溶液,再加入 | 若 若 品红溶液褪色,则假设3成立. |
考点:性质实验方案的设计
专题:实验题,实验设计题
分析:(1)按照气体的制备、除杂、收集、尾气处理的步骤连接实验装置;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,碳酸钙不溶于水,加入盐酸,次氯酸具有漂白性,可使品红褪色.
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,碳酸钙不溶于水,加入盐酸,次氯酸具有漂白性,可使品红褪色.
解答:
解:(1)实验室制取氯气时,首先要制取氯气,然后通过饱和食盐水除去挥发出来的氯化氢气体,通过浓硫酸除去混入的水蒸气,这时得到了干燥、纯净的氯气,要用向下排空气法收集氯气,最后要吸收多余的氯气,注意防止倒吸,仪器连接为H→B→A→C→D→E,
故答案为:B;A;C; D;E; 饱和食盐水;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)①漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,则漂白粉未变质,只含Ca(ClO)2,漂白粉全部变质,只含CaCO3,漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3.
故答案为:CaCO3;
②可加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中,若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立;
向步骤①反应后的试管滴入1~2滴品红溶液,振荡,若品红褪色,则假设3成立;若品红不褪色,则假设2成立.
故答案为:
故答案为:B;A;C; D;E; 饱和食盐水;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)①漂白粉的主要成分为氯化钙和次氯酸钙,变质生成碳酸钙,则漂白粉未变质,只含Ca(ClO)2,漂白粉全部变质,只含CaCO3,漂白粉部分变质,既含有Ca(ClO)2又含有CaCO3.
故答案为:CaCO3;
②可加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中,若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立;
向步骤①反应后的试管滴入1~2滴品红溶液,振荡,若品红褪色,则假设3成立;若品红不褪色,则假设2成立.
故答案为:
| 实验步骤 | 预期现象和结论 | |
| ① | 加入适量1mol/L盐酸溶解后,再将产生的气体导入到澄清石灰水中 | 若澄清石灰水未见浑浊,则假设1成立;若澄清石灰水变浑浊,则假设2或假设3成立 |
| ② | 向步骤①反应后的试管滴入1~2滴品红溶液,振荡 | 若品红不褪色,则假设2成立;若品红褪色,则假设3成立. |
点评:本题易氯气为载体考查性质实验,侧重于学生的实验能力的考查,为高考常见题型和高频考点,难度不大,注意把握物质的性质以及实验原理.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是( )
| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、离子Y2-和Z3+的核外电子数和电子层数均相同 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
将2mol SO2和2mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)?2SO3(g),平衡时SO3为W mol.相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
| A、2 mol SO2+1 mol O2 |
| B、4 mol SO2+1 mol O2 |
| C、2 mol SO2+1 mol O2+2 mol SO3 |
| D、3 mol SO2+1 mol SO3 |
将氯化钠、乙醇、碘分别从以下三种混合物中分离出来,①食盐水②乙醇溶液③碘水( )
| A、蒸馏、萃取、蒸发 |
| B、萃取、蒸馏、蒸发 |
| C、蒸发、萃取、蒸馏 |
| D、蒸发、蒸馏、萃取 |
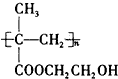 制成超薄镜片,其合成路线可以是:
制成超薄镜片,其合成路线可以是: