题目内容
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
D、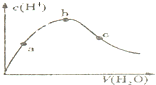 向冰醋酸中逐渐加水,有如图变化.a、b、c三点中水的电离程度最大的是b点 |
考点:离子浓度大小的比较,酸碱混合时的定性判断及有关ph的计算
专题:
分析:A.pH=7时,c(OH-)=c(H+),根据电荷守恒判断c(SO42-)、c(NH4+)相对大小;
B.相同温度下,醋酸浓度越大其电离程度越小;
C.室温下,pH=11的NaOH溶液浓度小于pH=3醋酸浓度,二者等体积混合,醋酸有剩余;
D.向冰醋酸中逐渐加水,酸的浓度越小其电离程度越大.
B.相同温度下,醋酸浓度越大其电离程度越小;
C.室温下,pH=11的NaOH溶液浓度小于pH=3醋酸浓度,二者等体积混合,醋酸有剩余;
D.向冰醋酸中逐渐加水,酸的浓度越小其电离程度越大.
解答:
解:A.pH=7时,c(OH-)=c(H+),根据电荷守恒得2c(SO42-)=c(NH4+),故A错误;
B.相同温度下,醋酸浓度越大其电离程度越小,两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1>10c2,故B错误;
C.室温下,pH=11的NaOH溶液浓度小于pH=3醋酸浓度,二者等体积混合,醋酸有剩余,溶液呈酸性,故C正确;
D.向冰醋酸中逐渐加水,酸的浓度越小其电离程度越大,所以a、b、c三点中水的电离程度最大的是c点,故D错误;
故选C.
B.相同温度下,醋酸浓度越大其电离程度越小,两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1>10c2,故B错误;
C.室温下,pH=11的NaOH溶液浓度小于pH=3醋酸浓度,二者等体积混合,醋酸有剩余,溶液呈酸性,故C正确;
D.向冰醋酸中逐渐加水,酸的浓度越小其电离程度越大,所以a、b、c三点中水的电离程度最大的是c点,故D错误;
故选C.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,知道弱电解质浓度与其电离程度的关系,题目难度不大.

练习册系列答案
相关题目
下列叙述中不正确的是( )
| A、“水滴石穿”可能的原因是溶解了CO2的雨水与CaCO3作用生成了可溶性Ca(HCO3)2的缘故 |
| B、25℃时,难溶物XY和AB3的Ksp分别为1.0×10-10和2.7×10-15,则该温度下,两者的饱和溶液中c(X+)一定大于c(A3+) |
| C、25℃时,pH=ll的KaA溶液和pH=11的KOH溶液,水电离的c(OH-)前者是后者的108倍 |
| D、不用其它试剂能把NaCl、AlCl3、Ba(OH)2三种溶液鉴别出来 |
在下列各组溶液中,离子一定能大量共存的是( )
| A、含有0.1 mol?L-1H+的溶液中:NO3-、Na+、Cl-、Fe2+ |
| B、无色透明的溶液中:K+、Mg2+、Cl-、SO42- |
| C、强碱性溶液中:Na+、SO42-、HCO3-、K+ |
| D、能与铝反应生成H2的溶液中:Na+、Al3+、Cl-、SO42- |
下列不属于人体的微量元素的是( )
| A、碘 | B、铁 | C、锌 | D、钙 |
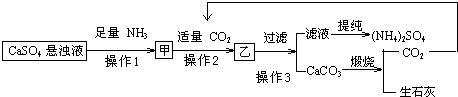
 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol.
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X和H是固体,B和G是液体,其余均为气体,1mol X分解得到A、B、C各1mol.

 某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.
某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.