题目内容
(NH4)2SO4是农业生产中常见化肥之一,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉制成CaSO4悬浊液,然后按如下工艺流程进行产生:
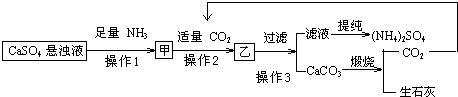
(1)操作1与操作2的顺序能否调换? (填能与否),理由是
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5X10-3g和2.1X10-1g,请解析CaSO4向CaCO3转化的原因.
(3)判断操作2通入“适量CO2”的简单实验方法是
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是 .
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是 .

(1)操作1与操作2的顺序能否调换?
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5X10-3g和2.1X10-1g,请解析CaSO4向CaCO3转化的原因.
(3)判断操作2通入“适量CO2”的简单实验方法是
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的氨水易和二氧化碳反应;
(2)沉淀转化原理:溶解度小的沉淀转化成溶解度更小的沉淀;
(3)根据就二氧化碳过量,会继续和NaOH溶液反应而变浑浊来判断;
(4)从原料的循环使用角度来回答;
(5)向胶体中加入电解质,胶体发生聚沉,据此回答.
(2)沉淀转化原理:溶解度小的沉淀转化成溶解度更小的沉淀;
(3)根据就二氧化碳过量,会继续和NaOH溶液反应而变浑浊来判断;
(4)从原料的循环使用角度来回答;
(5)向胶体中加入电解质,胶体发生聚沉,据此回答.
解答:
解:(1)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的氨水易和二氧化碳反应,能把CaSO4完全转化为CaCO3,操作1与操作2的顺序不能调换;
故答案为:否,中性条件下CO2的溶解度很小,不能把CaSO4完全转化为CaCO3;
(2)从CaSO4向CaCO3转化中并存着沉淀溶解平衡:CaSO4(s)?Ca2++SO42-,Ca2++CO32-?CaCO3(s),随着CO2通入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀,即CaSO4向CaCO3转化,
故答案为:从CaSO4向CaCO3转化中并存着沉淀溶解平衡:CaSO4(s)?Ca2++SO42-,Ca2++CO32-?CaCO3(s),随着CO2通入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀;
(3)操作2通入“过量CO2”,取少量滤液至试管中,加入少量NaOH溶液,会继续和NaOH溶液反应而变浑浊,据此检验二氧化碳的过量与否,
故答案为:取少量滤液至试管中,加入少量NaOH溶液,无浑浊出现则操作2通入“适量CO2”;
(4)在制取中,原料是可以循环使用的,将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液,故答案为:将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液;
(5)豆腐的制作过程中,使用了石膏或盐卤,这样可以使豆浆胶体聚沉,故答案为:胶体中加入电解质,胶体发生聚沉.
故答案为:否,中性条件下CO2的溶解度很小,不能把CaSO4完全转化为CaCO3;
(2)从CaSO4向CaCO3转化中并存着沉淀溶解平衡:CaSO4(s)?Ca2++SO42-,Ca2++CO32-?CaCO3(s),随着CO2通入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀,即CaSO4向CaCO3转化,
故答案为:从CaSO4向CaCO3转化中并存着沉淀溶解平衡:CaSO4(s)?Ca2++SO42-,Ca2++CO32-?CaCO3(s),随着CO2通入,CO32-浓度增大,平衡向CaSO4溶解和CaCO3沉淀生成的方向移动,即溶解度小的沉淀转化成溶解度更小的沉淀;
(3)操作2通入“过量CO2”,取少量滤液至试管中,加入少量NaOH溶液,会继续和NaOH溶液反应而变浑浊,据此检验二氧化碳的过量与否,
故答案为:取少量滤液至试管中,加入少量NaOH溶液,无浑浊出现则操作2通入“适量CO2”;
(4)在制取中,原料是可以循环使用的,将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液,故答案为:将滤液提纯(NH4)2SO4后的所有液体用于制CaSO4悬浊液;
(5)豆腐的制作过程中,使用了石膏或盐卤,这样可以使豆浆胶体聚沉,故答案为:胶体中加入电解质,胶体发生聚沉.
点评:本题是一道关于物质的分离制备方法的实验设计题,考查学生分析和解决问题的能力,难度大.

练习册系列答案
相关题目
观察如图,下列叙述中错误的是( )
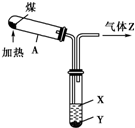

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
 已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)+c(OH-)=10-3mol?L-1 | ||
| B、b点所示的溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+) | ||
| C、c点的含义为:CH3COOH和NaOH恰好反应完全 | ||
D、a、b、c、d点表示的溶液中
|
恒温恒容条件下,存在可逆反应:aA(g)?bB(g),当反应处于平衡状态时,下列说法中不正确的是( )
| A、无论a、b大小关系如何,再加入气体A时,平衡一定向正反应方向移动 |
| B、若a<b,再加入A并达到平衡时,A的体积分数较原平衡更大 |
| C、若a>b,再加入A时,A的转化率增大 |
| D、加入气体A后,当反应再次达到平衡时,反应速率与原平衡时的反应速率相等 |
今有下列仪器:铁架台、铁圈、铁夹、三脚架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、坩埚钳、火柴、滤纸,从缺乏必要的仪器和用品的角度考虑,不能进行的分离操作是( )
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm):下列关于该有机物的叙述正确的是( )


| A、该有机物不同化学环境的氢原子有6种 |
| B、该有机物属于芳香化合物 |
| C、键线式中的Et代表的基团为-CH3 |
| D、该有机物在一定条件下能够发生消去反应 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
D、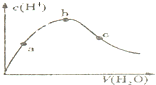 向冰醋酸中逐渐加水,有如图变化.a、b、c三点中水的电离程度最大的是b点 |
已知:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1.现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol?L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为( )
| A、△H1=△H2>△H3 |
| B、△H3>△H2>△H1 |
| C、△H2>△H1>△H3 |
| D、△H3>△H1>△H2 |