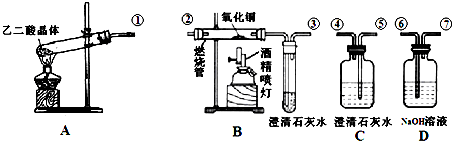
题目内容
下列叙述中不正确的是( )
| A、“水滴石穿”可能的原因是溶解了CO2的雨水与CaCO3作用生成了可溶性Ca(HCO3)2的缘故 |
| B、25℃时,难溶物XY和AB3的Ksp分别为1.0×10-10和2.7×10-15,则该温度下,两者的饱和溶液中c(X+)一定大于c(A3+) |
| C、25℃时,pH=ll的KaA溶液和pH=11的KOH溶液,水电离的c(OH-)前者是后者的108倍 |
| D、不用其它试剂能把NaCl、AlCl3、Ba(OH)2三种溶液鉴别出来 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质的检验和鉴别的基本方法选择及应用
专题:实验评价题,电离平衡与溶液的pH专题
分析:A、碳酸钙与二氧化碳的水溶液反应生成可溶性的碳酸氢钙;
B、依据溶度积常数计算计算;
C、由pH计算即可;
D、依据试剂相互滴定的现象判断回答即可.
B、依据溶度积常数计算计算;
C、由pH计算即可;
D、依据试剂相互滴定的现象判断回答即可.
解答:
解:A、碳酸钙与二氧化碳的水溶液反应生成可溶性的碳酸氢钙,所以溶解了CO2的雨水能把石头穿透,故A正确;
B、c(X+)=
=10-5,c(A3+)=
≈1.4×10-5,故C(X+)<C(A3+),故B错误;
C、pH=11的KaA溶液中c(OH-)=
=10-3,pH=11的KOH溶液,水电离的c(OH-)=c(H+)=10-11,故前者是后者的
=108倍,故C正确;
D、NaCl、AlCl3、Ba(OH)2三种溶液分别为a,b,c,采取互滴的方法可以鉴别,故D正确,
故选B.
B、c(X+)=
| 1.0×10-10 |
| 3 | 2.7×10-15 |
C、pH=11的KaA溶液中c(OH-)=
| 10-14 |
| 10-11 |
| 10-3 |
| 10-11 |
D、NaCl、AlCl3、Ba(OH)2三种溶液分别为a,b,c,采取互滴的方法可以鉴别,故D正确,
故选B.
点评:本题主要考查的是难溶电解质的溶解平衡、有关水电离的pH计算等,题目难度不大.

练习册系列答案
相关题目
观察如图,下列叙述中错误的是( )
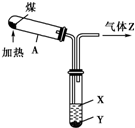

| A、图中操作发生了化学变化 |
| B、液体X的pH>7,液体Y是一种黑色黏稠状液体 |
| C、气体Z易燃,可还原CuO,但不能使溴水褪色 |
| D、试管A中得到的固体可用于工业炼铁、制粗硅等 |
下列有关生产生活涉及的操作和原理说法正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、铁钉镀锌,将锌与电源负极相连,电镀过程需要控制电流强度、溶液pH等条件 |
| C、海轮外壳绑上锌板是采用牺牲阳极的阴极保护法,从而减缓钢铁腐蚀速率 |
| D、电解精炼铜时,阳极溶解铜的总质量和阴极析出铜的总质量相等 |
CuO和Fe2O3的混合物m g,向其中加入1mol?L-1的HNO3溶液200mL恰好完全反应,若将2m g该混合物用足量CO还原,充分反应后剩余固体质量为( )
| A、3.2 g |
| B、(2m-3.2)g |
| C、(m-1.6)g |
| D、(2m-1.6)g |
 已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温时CH3COOH的电离平衡常数为Ka.该温度下向20mL 0.1mol?L-1CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)+c(OH-)=10-3mol?L-1 | ||
| B、b点所示的溶液中c(CH3COO-)+c(OH-)>(CH3COOH)+c(H+) | ||
| C、c点的含义为:CH3COOH和NaOH恰好反应完全 | ||
D、a、b、c、d点表示的溶液中
|
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
D、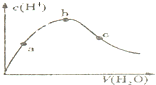 向冰醋酸中逐渐加水,有如图变化.a、b、c三点中水的电离程度最大的是b点 |