题目内容
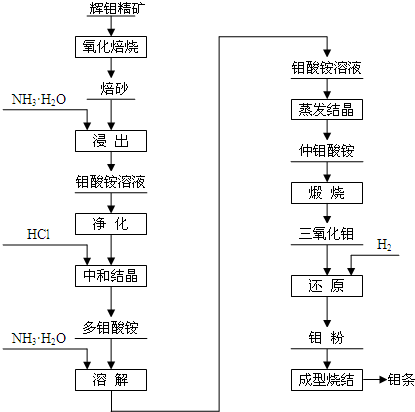
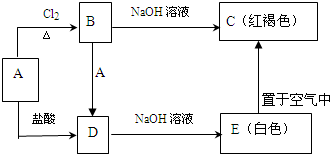
某金属A及其化合物之间有如下转化关系.请回答下列问题.
(1)A的化学式为 .
(2)A+B→D 反应的离子方程式为 .
(3)E置于空气中反应的化学方程式为 .
(1)A的化学式为
(2)A+B→D 反应的离子方程式为
(3)E置于空气中反应的化学方程式为

考点:无机物的推断
专题:推断题
分析:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,D与NaOH溶液得到E,E在空气中得到C,则D为FeCl2、E为Fe(OH)2,据此解答.
解答:
解:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,D与NaOH溶液得到E,E在空气中得到C,则D为FeCl2、E为Fe(OH)2,
(1)由上述分析可知,A为Fe;
故答案为:Fe;
(2)A+B→D 反应是铁和氯化铁反应生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+=2Fe2+;
故答案为:Fe+2Fe3+=2Fe2+;
(3)E→C的反应为氢氧化亚铁被空气中氧气氧化生成氢氧化铁,反应的化学方程式为为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(1)由上述分析可知,A为Fe;
故答案为:Fe;
(2)A+B→D 反应是铁和氯化铁反应生成氯化亚铁,反应的离子方程式为:Fe+2Fe3+=2Fe2+;
故答案为:Fe+2Fe3+=2Fe2+;
(3)E→C的反应为氢氧化亚铁被空气中氧气氧化生成氢氧化铁,反应的化学方程式为为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
点评:本题考查无机物推断,涉及Fe元素单质化合物性质,C为红褐色是推断突破口,难度不大,注意对基础知识的掌握.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
今有下列仪器:铁架台、铁圈、铁夹、三脚架、石棉网、烧杯、漏斗、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、坩埚钳、火柴、滤纸,从缺乏必要的仪器和用品的角度考虑,不能进行的分离操作是( )
| A、蒸发 | B、萃取 | C、过滤 | D、蒸馏 |
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)=c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2 |
| C、室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性 |
D、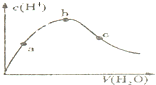 向冰醋酸中逐渐加水,有如图变化.a、b、c三点中水的电离程度最大的是b点 |
运用元素周期律分析下面的推断正确的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
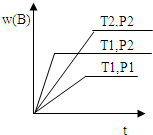 已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
已知某反应aA(g)+bB(g)?cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )| A、T1<T2,P1<P2,a+b>c,Q>0 |
| B、T1>T2,P1<P2,a+b<c,Q<0 |
| C、T1<T2,P1>P2,a+b<c,Q>0 |
| D、T1<T2,P1>P2,a+b>c,Q<0 |
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
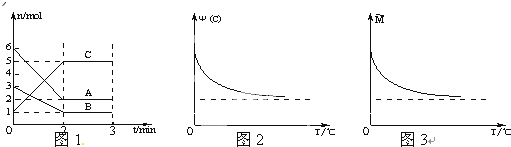

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
下列反应中,属于取代反应的是( )
| A、乙烯与溴反应制1,2-二溴乙烷 |
| B、苯酚与浓溴水反应生成三溴苯酚 |
| C、甲苯使酸性高锰酸钾溶液褪色 |
| D、在一定条件下苯与氢气反应制取环己烷 |