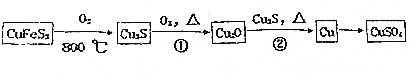题目内容
3. 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.(1)一座大型硫酸厂同时又是一座能源工厂,硫酸厂生产过程中的余热若能充分回收利用,不仅不需要外界供应能源,而且还可以向外界输出大量的热能.硫酸厂产生余热的主要设备有沸腾炉和接触室.
(2)硫酸厂产生的大量烧渣(硫铁矿煅烧后的灰渣)的用途是作高炉炼铁的原料(或回收有色金属、提取金银、制砖等合理答案都可)(写一种即可);写出电解精炼铜阳极泥的一种用途回收贵金属金、银等.
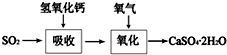
(3)工业制硫酸的尾气中含有的少量SO2,可先用氨水吸收,再用稀硫酸处理.
①该反应的化学方程式为SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];
②这样处理的优点是生成的SO2可用作制硫酸的原料,硫酸铵可作化肥.
(4)干熄焦技术是将炼焦炉推出的约1 000℃的赤热焦炭,在熄焦室中被其逆流的冷惰性气体(主要成分是氮气,温度在170~190℃)熄灭,被加热到700~800℃的惰性气体经除尘后进入余热锅炉,产生的过热蒸气送往汽轮发电机发电.干熄1t焦炭可产生500kg过热蒸气,可折合成46kg标准煤.举出两例采用逆流原理的化工设备或化学仪器热交换器、冷凝管(或工业制硫酸中的吸收塔).
(5)如图表示石灰-石膏法吸收SO2的工艺流程,写出反应的化学方程式SO2+Ca(OH)2═CaSO3↓+H2O,2CaSO3+O2+4H2O═2CaSO4•2H2O.
分析 (1)根据在沸腾炉和接触室中均发生放热反应分析;
(2)根据硫酸厂产生的大量烧渣的主要成分是Fe2O3分析用途;电解精炼铜阳极泥的主要成分是金、银等贵金属分析用途;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];
②生成的SO2可用作制硫酸的原料,硫酸铵可作化肥;
(4)采用逆流原理的化工设备或化学仪器 有:热交换器.冷凝管;
(5)二氧化硫与氢氧化钙反应生成亚硫酸钙与水,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O.
解答 解:(1)在沸腾炉和接触室中均发生放热反应,故硫酸厂产生余热的主要设备有 沸腾炉和接触室,
故答案为:沸腾炉和接触室;
(2)硫酸厂产生的大量烧渣的主要成分是Fe2O3,用途是 作高炉炼铁的原料(或回收有色金属、提取金银、制砖等合理答案都可);电解精炼铜阳极泥的主要成分是金、银等贵金属,所以一种用途回收贵金属金、银等,
故答案为:作高炉炼铁的原料(或回收有色金属、提取金银、制砖等合理答案都可);回收贵金属金、银等;
(3)①SO2通常用足量氨水吸收,然后再用稀硫酸处理,发生SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O],
故答案为:SO2+2NH3+H2O=(NH4)2SO3(或SO2+NH3+H2O=NH4HSO3)、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O[或2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O];
②优点为生成的(NH4)2SO4作化肥,二氧化硫可循环利用,生成的SO2可用作制硫酸的原料,硫酸铵可作化肥,
故答案为:生成的SO2可用作制硫酸的原料,硫酸铵可作化肥;
(4)采用逆流原理的化工设备或化学仪器 有:热交换器.冷凝管,
故答案为:热交换器 冷凝管(或工业制硫酸中的吸收塔);
(5)二氧化硫与氢氧化钙反应生成亚硫酸钙与水,反应方程式为:SO2+Ca(OH)2═CaSO3↓+H2O,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O,反应方程式为:2CaSO3+O2+4H2O=2CaSO4•2H2O,
故答案为:SO2+Ca(OH)2═CaSO3↓+H2O,2CaSO3+O2+4H2O═2CaSO4•2H2O.
点评 本题考查性质方案的设计,题目难度中等,涉及二氧化硫的污染与防治、硫酸制备,把握化学反应为解答的关键,侧重化学与技术及工业生产的考查.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案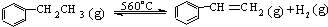 △H>0
△H>0针对上述反应,有人提出如下观点.其中合理的是( )
| A. | 在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率 | |
| B. | 在保持压强一定的条件下,充入不参加反应的气体,有利于提高苯乙烯的产率 | |
| C. | 在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大 | |
| D. | 不断分离出苯乙烯可加快反应速率 |
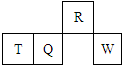 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | W对应的单质只可以跟强碱反应 |
| A. | N2 | B. | O2 | C. | .NaCl | D. | H2SO4溶液 |