题目内容
18.在稀硝酸中加入63.5g铜,直至完全反应:(1)铜的物质的量;
(2)反应中生成的气体体积(标准状况);
(3)反应中作氧化剂的硝酸的物质的量.
分析 (1)根据n=$\frac{m}{M}$计算Cu的物质的量;
(2)发生反应:3Cu+8HNO3(稀)=3Cu﹙NO3﹚2+2NO↑+4H2O,根据方程式计算生成NO的物质的量,再根据V=nVm计算NO的体积;
(3)作氧化剂的硝酸转化为NO,根据N原子守恒计算.
解答 解:(1)63.5g Cu的物质的量为$\frac{63.5g}{63.5g/mol}$=1mol,
答:铜的物质的量为1mol;
(2)发生反应:3Cu+8HNO3(稀)=3Cu﹙NO3﹚2+2NO↑+4H2O,
根据方程式可知生成NO的物质的量1mol×$\frac{2}{3}$,标况下NO的体积1mol×$\frac{2}{3}$×22.4L/mol=14.9L,
答:标况下生成NO的体积约是14.9L;
(3)作氧化剂的硝酸转化为NO,根据N原子守恒,反应中作氧化剂的硝酸的物质的量为1mol×$\frac{2}{3}$≈0.67mol,
答:反应中作氧化剂的硝酸的物质的量为0.67mol.
点评 本题考查化学方程式计算、氧化还原反应计算,比较基础,明确发生的反应即可解答,(3)中也可以根据电子转移守恒计算起氧化剂作用硝酸的物质的量.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
8.下列反应所得有机产物只有一种的是( )
| A. | 等体积的甲烷与氯气在光照条件下的取代反应 | |
| B. | 丙烯与氯化氢的加成反应 | |
| C. | 2-丙醇在浓硫酸作用下的消去反应 | |
| D. | 乙炔与溴水的加成反应 |
9.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2 L 0.5 mol/L硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 0.1 mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 3mol单质Fe完全转变为Fe3O4失去8NA个电子 |
10.有1L0.5mol/LNaOH溶液,取出0.2L后,以下对该溶液的叙述正确的是( )
| A. | 该溶液的体积变为0.8L | B. | 该溶液的物质的量浓度为0.5mol/L | ||
| C. | 该溶液的物质的量为0.5mol | D. | 该溶液的物质的量浓度为0.4mol/L |
7.同分异构现象是造成有机物数目繁多的原因之一.下列物质互为同分异构体的是( )


| A. | Ⅰ和Ⅱ | B. | Ⅱ和Ⅲ | C. | Ⅲ和Ⅳ | D. | Ⅰ和Ⅳ |
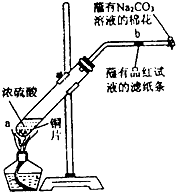 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题: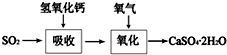 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.