题目内容
8.下列物质中属于化合物的是( )| A. | N2 | B. | O2 | C. | .NaCl | D. | H2SO4溶液 |
分析 化合物是一种含有至少两种元素组成的物质,单质是由同种元素组成的纯净物,化合物属于纯净物.若不是一种物质组成的,则为混合物.
解答 解:A、氮气是只含有一种元素氮元素的单质,故A错误;
B、氧气是只含有一种元素氧元素的单质,故B错误;
C、氯化钠,是一种由氯和钠两种元素组成的物质,则属于化合物,故C正确;
D、H2SO4溶液是硫酸的水溶液,则属于混合物,故D错误;
故选C.
点评 本题可根据物质的组成来判断化合物、单质、混合物,学生应熟悉常见物质的组成或成分,从物质的种类上来分析解答,题目难度不大.

练习册系列答案
相关题目
18.碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(1)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.
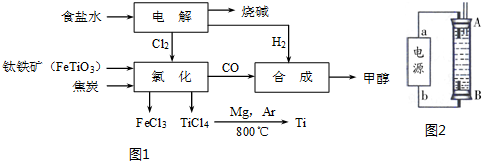
①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将向逆反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO.
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H22.0t.
(2)将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8-20e-+6H2O=3CO2+20H+;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①该反应的正反应为放(填“吸”或“放”)热反应;
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
(1)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图1所示),大大地提高了资源利用率,减少了环境污染.

①由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).
已知该反应在300℃时的化学平衡常数为0.27,该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将向逆反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
②写出钛铁矿经氯化得到四氯化钛的化学方程式:2FeTiO3+6C+7Cl2$\frac{\underline{\;通电\;}}{\;}$2FeCl3+2TiCl4+6CO.
③若不考虑生产过程中物质的任何损失,该产业链中每合成38.4t甲醇,至少需额外补充H22.0t.
(2)将两个石墨电极插入H2SO4溶液中,向两极分别通入C3H8和O2,构成丙烷燃料电池.
①负极电极反应式是:C3H8-20e-+6H2O=3CO2+20H+;
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图2所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD(填序号)
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-═H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=$\frac{1}{6}$;
③实验3跟实验2相比,改变的条件可能是使用了催化剂或增大了压强(答一种情况即可).
13.用NA标示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 0.5molH2O的分子数为1.5NA | B. | 0.5molNaCl的原子数为1 NA | ||
| C. | 28gCO的分子数为1 NA | D. | 32gO2的原子数为1 NA |
3.在配制过程中,下列操作不正确的是 ( )
| A. | 使用容量瓶前需检查它是否漏水 | |
| B. | 将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切 | |
| C. | 配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线 | |
| D. | 定容后盖好瓶塞,反复上下颠倒,摇匀 |


 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.