题目内容
15.选择下列实验方法分离物质,将分离方法的序号填在横线上:A.过滤 B.蒸发结晶 C.分液 D.蒸馏 E.萃取分液 F.升华
(1)C分离水和四氯化碳的混合物;
(2)A分离饱和氯化钾溶液和沙子的混合物;
(3)B从硝酸钾溶液中获得硝酸钾;
(4)D分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)的混合物;
(5)E从碘水中提取碘单质.
分析 (1)水和四氯化碳分层;
(2)沙子不溶于水;
(3)硝酸钾为可溶性固体;
(4)二者互溶,但沸点不同;
(5)碘不易溶于水,易溶于有机溶剂.
解答 解:(1)水和四氯化碳分层,则选择分液法分离,故答案为:C;
(2)沙子不溶于水,则选择过滤分离,故答案为:A;
(3)硝酸钾为可溶性固体,则利用蒸发结晶法得到,故答案为:B;
(4)二者互溶,但沸点不同,则选择蒸馏法分离,故答案为:D;
(5)碘不易溶于水,易溶于有机溶剂,则利用萃取分液法从碘水中提取碘单质,故答案为:E.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法的选择为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
5.下列有关说法正确的是( )
| A. | 实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液 | |
| B. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡时氢气转化率增大 | |
| C. | 吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的△S<0 | |
| D. | 在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了 |
10.有1L0.5mol/LNaOH溶液,取出0.2L后,以下对该溶液的叙述正确的是( )
| A. | 该溶液的体积变为0.8L | B. | 该溶液的物质的量浓度为0.5mol/L | ||
| C. | 该溶液的物质的量为0.5mol | D. | 该溶液的物质的量浓度为0.4mol/L |
7.同分异构现象是造成有机物数目繁多的原因之一.下列物质互为同分异构体的是( )


| A. | Ⅰ和Ⅱ | B. | Ⅱ和Ⅲ | C. | Ⅲ和Ⅳ | D. | Ⅰ和Ⅳ |
10.下列有关实验误差分析中,正确的是( )
| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
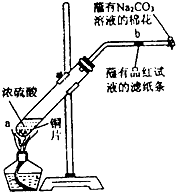 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题:
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.回答下列问题: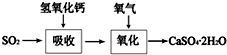 工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.
工业上常产生大量的废气、废水、废渣、废热,如果处理不好,随意排放,会造成污染,而如果科学回收,可变废为宝.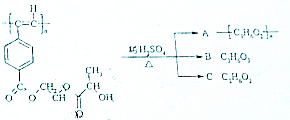 聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图:
聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,如图是聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解示意图: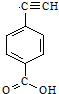 ;
;