题目内容
4.某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下所示: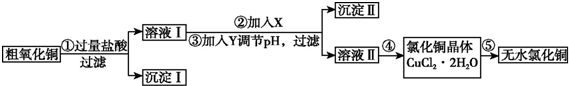
(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
分析 粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入CuO调节溶液的pH,所以Y可以是CuO,则沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,
(1)氧化铜和盐酸反应生成氯化铜和水;
(2)依据过滤装置中的仪器分析回答;
(3)操作②是加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢;步骤③是加入氧化铜调节溶液PH使铁离子完全沉淀;
(4)氯化氢抑制氯化铜的水解,以便达到氯化铜晶体.
解答 解:粗CuO中含有FeO和不溶于酸的杂质,将粗CuO溶于过量盐酸,发生的反应有FeO+2HCl=FeCl2+H2O、CuO+2HCl=CuCl2+H2O,然后过滤,得到沉淀I为不溶于酸的杂质,溶液I中溶质为FeCl2、CuCl2和HCl,向溶液I中加入X、Y然后调节pH过滤,得到沉淀II,溶液II,除去FeCl2、CuCl2和HCl中的FeCl2,根据氢氧化物沉淀需要的pH知,应该先将FeCl2氧化为铁盐,为不引进新的杂质,氧化剂X应该为Cl2或H2O2,然后向溶液中加入CuO调节溶液的pH,所以Y可以是CuO,则沉淀II为Fe(OH)3,然后将溶液II蒸发浓缩、冷却结晶得到CuCl2.2H2O,最后在HCl氛围中加热CuCl2.2H2O得到CuCl2,
(1)步骤①中氧化铜与盐酸反应氧化铜和盐酸反应生成氯化铜和水,反应的离子方程式是:CuO+2H+=Cu2++H2O,
故答案为:CuO+2H+=Cu2++H2O;
(2)过滤装置中的玻璃仪器有普通漏斗、玻璃棒、烧杯,
故答案为:普通漏斗、玻璃棒、烧杯;
(3)操作②是加入氧化剂把亚铁离子氧化为铁离子但不能引入新的杂质,氧化剂选择过氧化氢氧化亚铁离子的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
步骤③是加入氧化铜调节溶液PH到大于3.2,小于4.7,使铁离子完全沉淀;
故答案为:将Fe2+氧化成Fe3+;2Fe2++H2O2+2H+=2Fe3++2H2O;3.2至4.7;d;
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,是为了抑制铜离子的水解得到氯化铜晶体同时带走产生的水蒸气;
故答案为:干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
点评 本题考查混合物的分离和提纯,涉及除杂剂的选取、氧化还原反应、仪器的选取等知识点,侧重考查整体分析解答能力,会根据仪器的作用选取仪器,难点是确定调节溶液的pH时pH的取值范围,题目难度中等.

| A. | 1L 0.1mol/L醋酸 | B. | 1L 0.1mol/L硫酸 | ||
| C. | 0.5L0.1mol/L盐酸 | D. | 2L0.1moL/L的磷酸 |
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |

(1)铜帽溶解时加入H2O2 的目的是Cu+H2O2+H2SO4=CuSO4+2H2O(用化学方程式表示).铜帽溶解完全后,需将溶液中过量的H2O2 除去.除去H2O2 的简便方法是加热至沸.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的浓度.实验操作为:准确量取100mL含有Cu2+的溶液于烧杯中,取溶液20mL加水稀释至100mL,调节溶液pH=3~4,加入过量的KI,用0.1mol/L Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2 2S2O32-+I2═2I-+S4O62-
①滴定选用的指示剂为淀粉溶液
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会偏高(填“偏高”、“偏低”或“不变”).
③若滴定中消耗Na2S2O3标准溶液25mL,则原溶液中Cu2+物质的量浓度为0.125mol/L.
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成ZnO22-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol•L-1计算).
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
由除去铜的滤液制备ZnO 的实验步骤依次为:
①向滤液中加入30%H2O2,使其充分反应;②滴加1.0mol•L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全;③过滤;④向滤液中滴加1.0mol•L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全;⑤过滤、洗涤、干燥;⑥900℃煅烧.
| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
①加热KClO3和MnO2的混合物制取O2 ②蜡烛的燃烧 ③碳和二氧化碳在高温下反应 ④将氢氧化钡晶体和氯化铵晶体的混合物放入水中 ⑤将碳酸钠晶体和硝酸铵晶体混合均匀放在日光下暴晒 ⑥将黏土、石子、水混合均匀 ⑦将生石灰倒入海水中 ⑧煅烧石灰石.
| A. | ①③④⑤⑧ | B. | ③④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ①②④⑤⑧ |
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 多年来我国广大农村生火做饭使用的都是化石燃料 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |

| A. | 总反应式为:O2+2H2═2H2O | |
| B. | 正极的电极反应式为:O2+4H+═2H2O+4e- | |
| C. | 通入氧气的电极发生氧化反应 | |
| D. | 通入氢气的电极为正极 |