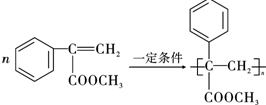
题目内容
14.2002年9月26日,中国北京曙光公司研制出了第-款具有我国完全自主知识产权的高性能CPU芯片--“龙芯”1号. (1)“龙芯”(芯片)关键材料的主要化学成分是Si(填化学式,下同).(2)计算机长距离联网传输很快的线路中使用的材料叫光导纤维,其主要化学成分是SiO2.
分析 (1)计算机芯片的成分是硅单质;
(2)光导纤维在一定时间内可以传输较大量的信息.
解答 解:(1)芯片的材料是硅,硅是信息技术的关键材料,故答案为:硅;
(2)光导纤维在一定时间内可以传输较大量的信息,主要成分是二氧化硅,故答案为:光导纤维;SiO2.
点评 本题主要考查硅和二氧化硅的性质、组成以及用途,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,11.2 L 水中含有的分子数为0.5NA | |
| B. | 标准状况下,22.4LN2中含有的原子数为NA | |
| C. | 23g Na与足量H2O反应转移的电子数为NA | |
| D. | 物质的量浓度为1 mol•Lˉ1的K2SO4溶液中,含2 NA个K+ |
5.在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
| A. | Ca2+、Fe2+、NO3-、HCO3- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | K+、AlO2-、Cl-、SO42- | D. | Na+、Cl-、CO32-、SO32- |
2.下列说法正确的是( )
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
6.已知:相关物质的溶度积常数见表:
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

(1)最适合作氧化剂X的是C(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
3.在标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为( )
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
4.某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下所示:
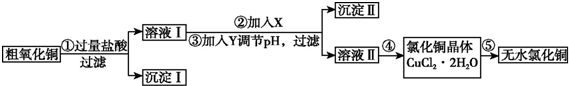
(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
参照表中给出的数据和试剂,请回答:
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.

(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
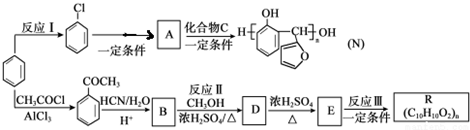
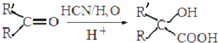
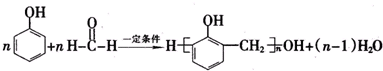
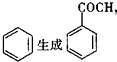 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•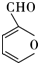
 .
.