题目内容
12.下列物质①NaHCO3 ②Al(OH)3 ③Al ④Al2O3中,跟盐酸和氢氧化钠溶液都能反应的是( )| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
分析 中学常见既能与酸又能与碱反应的物质有:铝、两性氧化物、两性氢氧化物、弱酸酸式盐、弱酸的铵盐、氨基酸、蛋白质等.
解答 解:①NaHCO3属于强碱弱酸酸式盐,能和稀盐酸、NaOH溶液反应,故正确;
②Al(OH)3属于两性氢氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,故正确;
③Al能和稀盐酸、NaOH溶液反应生成盐和氢气,故正确;
④Al2O3属于两性氧化物,能和稀盐酸、NaOH溶液反应生成盐和水,故正确;
故选D.
点评 本题考查元素化合物性质,为高频考点,关键是元素化合物性质的掌握,注意归纳总结常见能与酸、碱反应的物质,题目难度不大.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
2.下列说法正确的是( )
| A. | 在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) | |
| B. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| C. | 在难溶电解质的饱和溶液中,电解质的Ksp越小,其物质的量浓度越小 | |
| D. | 反应5S2O82-+2Mn2++8H20═10SO42-+2MnO4-+16H+,得电子的元素是氧元素,反应中转移10e- |
3.在标准状况下,1 L的密闭容器中恰好可盛放n个N2分子和m个H2分子组成的混合气体,则阿伏加德罗常数的数值可近似表示为( )
| A. | 22.4(m+n) | B. | 22.4×6.02×1023(m+n) | ||
| C. | 22.4×6.02×1032(m+n) | D. | $\frac{6.02×1{0}^{23}(m+n)}{22.4}$ |
7.下列反应的离子方程式不正确的是( )
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
4.某化学小组用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜,其实验流程如下所示:
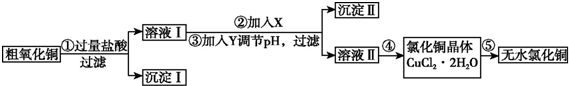
(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
参照表中给出的数据和试剂,请回答:
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.

(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
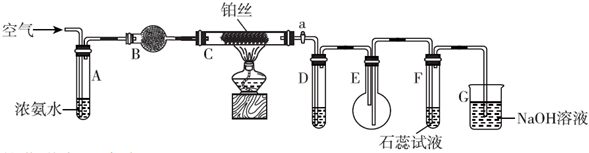
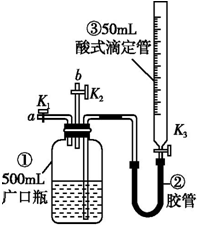 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理. (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式