题目内容
9.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述正确的是( )| A. | 开始加入合金的质量可能为3.0 g | |
| B. | 参加反应的硝酸的物质的量是0.1 mol | |
| C. | 完全生成沉淀时消耗NaOH溶液的体积为100 mL | |
| D. | 溶解合金时收集到NO气体的体积为2.24 L |
分析 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据电子注意计算金属总物质的量,金属的总质量与金属的含量有关,假定全为镁、全为铜计算确定金属的质量范围;
B.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属);
C.n(NaOH)=n(OH-),根据V=$\frac{n}{c}$计算加入的氢氧溶液的体积;
D.根据电子转移守恒计算n(NO),然后计算出标况下一氧化氮的体积.
解答 将一定量的镁和铜组成的混合物加入到稀HNO3中,金属完全溶解(假设反应中还原产物只有NO),发生反应:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反应后的溶液中加入过量的3mol/L NaOH溶液至沉淀完全,发生反应:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀为氢氧化镁和氢氧化铜,生成沉淀的质量比原合金的质量增加5.1g,则氢氧化镁和氢氧化铜含有氢氧根的质量为5.1g,氢氧根的物质的量为$\frac{5.1g}{17g/mol}$=0.3mol,根据电子转移守恒,则镁和铜的总的物质的量为0.15mol,
A.根据反应方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,镁和铜的总的物质的量为铜离子物质的量的一半,即:$\frac{0.3mol}{2}$=0.15mol,假定全为镁,金属质量为0.15mol×24g/mol=3.6g,若全为铜,金属质量为:0.15mol×64g/mol=9.6g,所以参加反应的金属的总质量(m)范围为:3.6g<m<9.6g,则金属质量不可能为3.0g,故A错误;
B.根据方程式可知参加反应的n反应(HNO3)=$\frac{8}{3}$n(金属)=$\frac{8}{3}$×0.15mol=0.4mol,故B错误;
C.反应消耗氢氧化钠的物质的量为:n(NaOH)=n(OH-)=0.3mol,则加入的氢氧化钠溶液的体积为:V=$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故C正确;
D.金属的物质的量为0.15mol,完全反应失去0.15mol×2=0.3mol电子,根据电子转移守恒,生成一氧化氮的物质的量为:n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,在标准状况下0.1molNO的体积为2.24L,故D错误;
故选C.
点评 本题主要考查混合物有关计算,涉及镁铜与硝酸反应、生成的盐与氢氧化钠反应,侧重于学生的得失电子守恒、质量守恒等综合运用和解决复杂问题的能力的考查,是一道考查能力的好题,难度中等.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案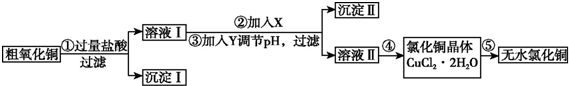
(1)步骤①中氧化铜与盐酸反应的离子方程式是CuO+2H+=Cu2++H2O.
(2)步骤①、③的过滤操作中,除用到铁架台(带铁圈)外,还需要使用的玻璃仪器是普通漏斗、玻璃棒、烧杯.
(3)已知:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的试剂:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
步骤②的目的是将Fe2+氧化成Fe3+,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
步骤③中调节溶液pH的范围是3.2至4.7,试剂Y是d(填字母).
(4)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2•2H2O,其原因是干燥的HCl气流既可抑制Cu2+的水解,还能带走CuCl2•2H2O受热产生的水汽.
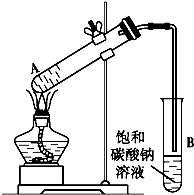 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如下图所示.有关数据及副反应:
| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
(2)试管B中导管接近液面未伸入液面下的理由是防止倒吸.
(3)现对试管B中乙酸乙酯粗产品进行提纯,步骤如下:
①将试管B中混合液体充分振荡后,转入分液漏斗(填仪器名称)进行分离;
②向分离出的上层液体中加入无水硫酸钠,充分振荡.加入无水硫酸钠的目的是除去乙酸乙酯中的水.
③将经过上述处理的液体放入干燥的蒸馏烧瓶中,对其进行蒸馏,收集77℃左右的液体即得纯净的乙酸乙酯.
(4)从绿色化学的角度分析,使用浓硫酸制乙酸乙酯不足之处主要有产生酸性废水,污染环境,同时发生副反应.
(5)炒菜时,加一点白酒和醋能使菜肴味香可口,试用符合实际情况的化学方程式解释:CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
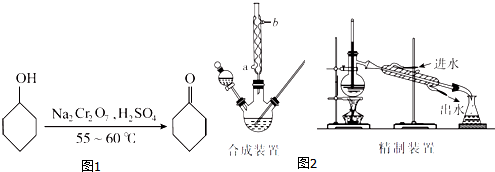
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取100mL(填“100 mL”或“250 mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是环己酮和水的混合物.
(4)合成装置中冷凝管的作用是冷凝回流,冷凝水从冷凝管的a(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是降低有机物在水层得溶解度,有利于液体分层.
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集B(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是温度计的水银球未与蒸馏烧瓶支管口平齐(或冷凝水进、出口方向颠倒).(任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是70%.
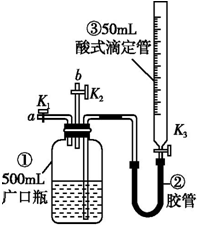 某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.
某活动小组利用如图装置验证NO的还原性及探究工业生产硝酸的原理.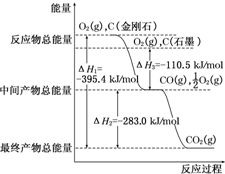 (1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式
(1)家用液化气中主要成分之一是丁烷(C4H10).当1g丁烷完全燃烧并生成CO2和液态水时,放出热量50kJ.试写出丁烷燃烧反应的热化学方程式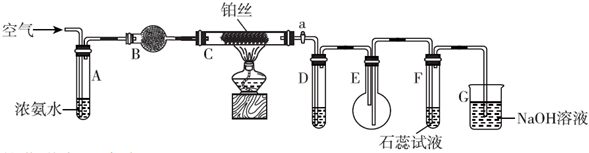
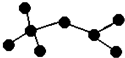 如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题:
如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子),回答下列问题: