题目内容
1.某温度(t℃)时,水的KW=1×10-13,则该温度(填“大于”、“小于”或“等于”)大于25℃,其理由是25℃时KW=10-14,升高温度水的电离平衡正向移动,使KW增大.将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合,若所得混合液为中性,则a:b=10:1.分析 水的电离是吸热过程,升高温度促进水电离,导致水的离子积常数增大;该温度下pH=1的硫酸中c(H+)=0.1mol/L、pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,要使混合溶液呈中性,说明n(H+)=n(OH-).
解答 解:水的电离是吸热过程,升高温度促进水电离,导致水的离子积常数增大,该温度下KW=1×10-13>1×10-14,说明该温度大于25℃,该温度下pH=1的硫酸中c(H+)=0.1mol/L、pH=11的NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,要使混合溶液呈中性,说明n(H+)=n(OH-),即0.01mol/L×aL=0.1mol/L×bL,a:b=10:1,
故答案为:大于;25℃时KW=10-14,升高温度水的电离平衡正向移动,使KW增大;10:1.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断及计算能力,明确溶液中离子浓度与pH的关系是解本题关键,知道温度对水电离平衡移动的影响原理,题目难度不大.

练习册系列答案
相关题目
11.已知:2C(s)+O2(g)═2CO(g)△H=-Q1 kJ•mol-1;
C(s)+O2(g)═CO2(g)△H=-Q2 kJ•mol-1;
S(s)+O2(g)═SO2(g)△H=-Q3 kJ•mol-1.
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为( )
C(s)+O2(g)═CO2(g)△H=-Q2 kJ•mol-1;
S(s)+O2(g)═SO2(g)△H=-Q3 kJ•mol-1.
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为( )
| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-2Q2+Q3) kJ•mol-1 | |
| B. | S(s)+2CO(g)═SO2(g)+2C(s)△H=(Q1-Q3) kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(Q1-2Q2+Q3) kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-Q2+2Q3) kJ•mol-1 |
12.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
| A. | 不是在室温下 | B. | 弱酸溶液与强碱溶液反应 | ||
| C. | 强酸溶液与强碱溶液反应 | D. | 二元强酸溶液和一元强碱溶液反应 |
9. 请完成下列问题
请完成下列问题
(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
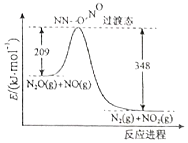
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
则表中a=354.
 请完成下列问题
请完成下列问题(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
16.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 醋酸溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 向稀盐酸溶液中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
13.容量瓶是一种定量仪器,其瓶身上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥密度
这六项中的( )
这六项中的( )
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
10.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,32 g O3含有的氧原子数目为2NA | |
| B. | 5.6 g的Fe在足量Cl2中完全燃烧转移电子数为0.2NA | |
| C. | 0.1 mol•L-1 Na2SO4溶液含有的钠离子数目为0.2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
14.已知①Fe(s)+CO2(g)?FeO(s)+CO(g)?K1
②Fe(s)+H2O(g)?FeO(s)+H2(g)?K2
③H2(g)+CO2(g)?H2O(g)+CO(g)?K3
又已知在不同的温度下,K1、K2数值如表:
(1)若500℃时进行反应①,CO2起始浓度为2mol/L,2分钟后建立平衡,则CO2的转化率为50%,用CO表示反应速率为0.5mol/(L•min).
(2)反应②的平衡常数表达式为K=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$,此反应在恒温恒容的密闭装置中进行,能充分说明此反应已达到平衡的标志是AB.
A.气体的平均相对分子质量不再改变 B.气体的总质量不再改变
C.气体的总分子数不再改变 D.容器内压强不随时间变化而变化
(3)若900℃时进行反应 ③,其平衡常数K3为1.5(求具体数值),焓变△H>0(填“>”、“<”、“=”).若已知该反应仅在高温时自发进行,则△S>0(填“>”、“<”、“=”).
(4)若500℃时进行反应 ③,在某时刻时C(H2)=C(CO2)=C(H2O)=C(CO),则此时否(填“是”、“否”)达到平衡状态;若没有达到平衡状态,则此时该反应正在向逆(填“正”、“逆”)方向进行,理由为:浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动.
②Fe(s)+H2O(g)?FeO(s)+H2(g)?K2
③H2(g)+CO2(g)?H2O(g)+CO(g)?K3
又已知在不同的温度下,K1、K2数值如表:
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)反应②的平衡常数表达式为K=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$,此反应在恒温恒容的密闭装置中进行,能充分说明此反应已达到平衡的标志是AB.
A.气体的平均相对分子质量不再改变 B.气体的总质量不再改变
C.气体的总分子数不再改变 D.容器内压强不随时间变化而变化
(3)若900℃时进行反应 ③,其平衡常数K3为1.5(求具体数值),焓变△H>0(填“>”、“<”、“=”).若已知该反应仅在高温时自发进行,则△S>0(填“>”、“<”、“=”).
(4)若500℃时进行反应 ③,在某时刻时C(H2)=C(CO2)=C(H2O)=C(CO),则此时否(填“是”、“否”)达到平衡状态;若没有达到平衡状态,则此时该反应正在向逆(填“正”、“逆”)方向进行,理由为:浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动.
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测: