题目内容
14.已知①Fe(s)+CO2(g)?FeO(s)+CO(g)?K1②Fe(s)+H2O(g)?FeO(s)+H2(g)?K2
③H2(g)+CO2(g)?H2O(g)+CO(g)?K3
又已知在不同的温度下,K1、K2数值如表:
| 温度℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
(2)反应②的平衡常数表达式为K=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$,此反应在恒温恒容的密闭装置中进行,能充分说明此反应已达到平衡的标志是AB.
A.气体的平均相对分子质量不再改变 B.气体的总质量不再改变
C.气体的总分子数不再改变 D.容器内压强不随时间变化而变化
(3)若900℃时进行反应 ③,其平衡常数K3为1.5(求具体数值),焓变△H>0(填“>”、“<”、“=”).若已知该反应仅在高温时自发进行,则△S>0(填“>”、“<”、“=”).
(4)若500℃时进行反应 ③,在某时刻时C(H2)=C(CO2)=C(H2O)=C(CO),则此时否(填“是”、“否”)达到平衡状态;若没有达到平衡状态,则此时该反应正在向逆(填“正”、“逆”)方向进行,理由为:浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动.
分析 (1)利用500℃时K1=$\frac{[CO]}{[CO{\;}_{2}]}$=1,说明CO和二氧化碳的平衡浓度相等,再结合CO2起始浓度为2mol/L求算平衡时CO和二氧化碳的平衡浓度,据此计算;
(2)根据平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积;可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(3)K1=$\frac{[CO]}{[CO{\;}_{2}]}$,K2=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$;K3=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$,依据反应①②的平衡常数计算反应③的平衡常数,据此解答;
(4)利用浓度商与平衡常数的大小关系判断.
解答 解:(1)500℃时K1=$\frac{[CO]}{[CO{\;}_{2}]}$=1,说明CO和二氧化碳的平衡浓度相等,CO2起始浓度为2mol•L-1,所以CO和二氧化碳的平衡浓度均为1mol/L,所以CO2的转化率为$\frac{1mol/L}{2mol/L}$×100%=50%,v(CO)=$\frac{1mol/L}{2min}$=0.5mol/(L•min),故答案为:50%;0.5mol/(L•min);
(2)反应②的平衡常数表达式为K2=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$;
A.气体的物质的量不变,随反应进行,气体的总质量减小,则平均相对分子质量减小,所以平均相对分子质量不变,说明到达平衡状态,故A正确;
B.随反应进行,气体的总质量减小,则气体的总质量不再改变,说明到达平衡状态,故B正确;
C.气体的物质的量一直不变,则气体的总分子数不再改变不能说明到达平衡状态,故C错误;
D.随反应进行,气体的物质的量不变,则压强不变,所以容器内压强不随时间变化而变化,不能说明到达平衡状态,故D错误;
故答案为:$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$;AB;
(3)K1=$\frac{[CO]}{[CO{\;}_{2}]}$,K2=$\frac{[H{\;}_{2}]}{[H{\;}_{2}O]}$;K3=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$,依据反应①②的平衡常数计算反应③的平衡常数,K3=$\frac{K{\;}_{1}}{K{\;}_{2}}$=$\frac{2.4}{1.6}$=1.5;K1随温度升高而增大,K2随温度升高而减小,所以K3随温度升高而增大,说明正反应吸热,△H>0;当△H-T△S<0时,反应自发进行,仅在高温时自发进行,且△H>0,则△S>0,
故答案为:1.5;>;>;
(4)若500℃时进行反应 ③,K3=$\frac{K{\;}_{1}}{K{\;}_{2}}$=$\frac{1.00}{3.15}$=0.317,在某时刻时C(H2)=C(CO2)=C(H2O)=C(CO),则浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动,故答案为:否;逆;浓度商=$\frac{[CO]•[H{\;}_{2}O]}{[H{\;}_{2}]•[CO{\;}_{2}]}$=1>K3,所以此时平衡向逆反应方向移动.
点评 本题考查了化学平衡转化率、反应速率以及常数的计算、反应自发进行的条件等,题目难度中等,要求学生具有分析和解决问题的能力.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应 | |
| B. | 弱碱性条件下,甲酸乙酯能与氢氧化铜反应,乙酸乙酯也能与氢氧化铜反应 | |
| C. | 苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色 | |
| D. | CO2与SiO2均为酸性氧化物,CO2能与NaOH溶液反应,SiO2也能与NaOH溶液反应 |
| A. | Na2O、Na2O2、Al2O3、CuO都是碱性氧化物 | |
| B. | 纯碱、烧碱均属碱类 | |
| C. | NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 | |
| D. | HCl、CH3COOH、HNO3都是强酸 |
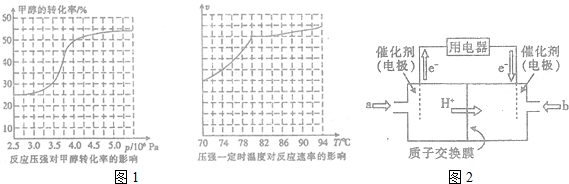

 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.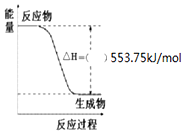 按要求写出298K、101kPa时下列反应的热化学方程式:
按要求写出298K、101kPa时下列反应的热化学方程式:
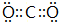 .
.