题目内容
3. 回答下列问题:
回答下列问题:(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:A;
A.c(H+)
B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-)
D.c(OH-)/c(H+)
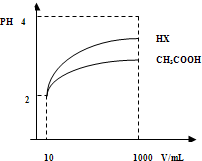
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”);
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol/L.(填准确数值).
分析 (1)CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,c(OH-)增大,Kw不变;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(3)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-).
解答 解:(1)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A正确;
B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中比值变大,故B错误;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)•c(OH-)=Kw,Kw不变,故C错误;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则c(OH-)/c(H+)变大,故D错误;
故答案为:A;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,
故答案为:大于;大于;
(3)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,
故答案为:9.9×10-7mol/L.
点评 本题考查弱电解质的电离平衡及其影响、pH与酸的稀释等知识,题目难度中等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,充分考查了学生的灵活应用能力.

| A. | 原子的最外层电子数等于族序数 | |
| B. | 主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 | |
| C. | 分子结构相似的分子相对分子质量越大熔沸点越高 | |
| D. | 元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |
| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
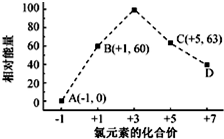 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.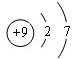 .
.