题目内容
8.下列各离子浓度的大小比较,正确的是( )| A. | 同浓度的下列溶液中:①(NH4)2Fe(SO4)2②(NH4)2CO3③(NH4)2SO4,c(NH+4)由大到小的顺序是:①>③>② | |
| B. | 常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) | |
| C. | 0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
分析 A.亚铁离子抑制铵根离子水解、碳酸根离子促进铵根离子水解,铵根离子水解程度越大,其溶液中c(NH+4)越小;
B.常温下,将等体积的盐酸和氨水混合后,pH=7,则c(OH-)=c(H+),根据电荷守恒判断;
C.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
D.0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NH4Cl、NaCl、NH3.H2O,混合溶液显碱性,说明一水合氨电离程度大于铵根离子水解程度.
解答 解:A.亚铁离子抑制铵根离子水解、碳酸根离子促进铵根离子水解,铵根离子水解程度越大,其溶液中c(NH+4)越小,所以c(NH+4)由大到小的顺序是:①>③>②,故A正确;
B.常温下,将等体积的盐酸和氨水混合后,pH=7,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=c(Cl-),故B错误;
C.任何电解质溶液中都存在质子守恒,根据质子守恒:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C错误;
D.0.1mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合,溶液中溶质为等物质的量浓度的NH4Cl、NaCl、NH3.H2O,混合溶液显碱性,说明一水合氨电离程度大于铵根离子水解程度,结合物料守恒得c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故D错误;
故选A.
点评 本题考查离子浓度大小比较,为高频考点,明确盐类水解、弱电解质的电离是解本题关键,注意电荷守恒、物料守恒的灵活运用,题目难度不大.

练习册系列答案
相关题目
18.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 88.0g 干冰中含有的电子数为8.0NA | |
| B. | 常温下,11.2L乙烯在氧气中完全燃烧转移的电子数为6.0NA | |
| C. | 常温下1.0L0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| D. | 1.2g金刚石中含有的碳碳键数为0.4NA |
13.(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇. 某化学研究性学习小组模拟工业合成甲醇的反应(△H<0),在容积固定为2L的密闭容器内充入1molCO和 2molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
(1)从反应开始到20min时,以CO表示的平均反应速率=0.0125mol/(L•min),
(2)该温度下平衡常数K=4(mol/L)-2,,若升高温度则K值减小(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v (H2)正=v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
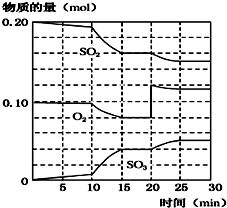
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1
(1)该反应500℃时的平衡常数<450℃时的平衡常数(填“>”、“<”或“=”).
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是15~20 min和25~30 min.
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增大O2浓度(通入O2);(用文字表达),10min到15min的曲线变化的原因可能是AB(填字母).
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是b.(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度.
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
(2)该温度下平衡常数K=4(mol/L)-2,,若升高温度则K值减小(填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是BC;
A.2v (H2)正=v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:

2SO2(g)+O2(g)?2SO3(g)△H=-190kJ•mol-1
(1)该反应500℃时的平衡常数<450℃时的平衡常数(填“>”、“<”或“=”).
(2)450℃时,在一2L密闭容器中,将二氧化硫和氧化混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是15~20 min和25~30 min.
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增大O2浓度(通入O2);(用文字表达),10min到15min的曲线变化的原因可能是AB(填字母).
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是b.(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度.
20.相同温度,相同物质的量浓度的五种溶液.按pH由大到小的顺序排列,正确的是( )
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |
18.下列事实不能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |
 回答下列问题:
回答下列问题: