题目内容
12.实验室欲用NaOH固体配制1.0mol•L-1240mL的NaOH溶液和用浓硫酸配制450mL0.5mol•L-1硫酸溶液根据这两种溶液的配制情况回答下列问题:(1)配制溶液时,一般可以分为以下几个步骤:
①称量或量取 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却.其正确的操作顺序为②①③⑧⑤⑥⑦④.
(2)可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤量筒;⑥容量瓶;⑦托盘天平;⑧药匙;⑨分液漏斗.根据这两种溶液的配制情况回答下列问题:上述仪器中,一直用不到的有②⑨(填序号).
(3)下列操作中,容量瓶所不具备的功能有BC(填字母).
A.配制一定体积准确浓度的标准溶液
B.长期储存溶液
C.用来加热溶解固体溶质
(4)配制此浓度的硫酸溶液,需选用容量瓶的规格500mL容量瓶;实验室提供质量分数 98%、密度为1.84g/cm3的浓硫酸,应量取浓硫酸13.6mL
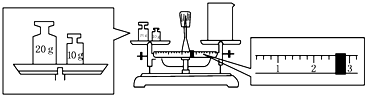
(5)某同学欲称量一定量的NaOH固体,先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为27.4 g,要完成本实验该同学应称出10.0 g NaOH.
(6)在配制溶液时下列操作会引起浓度偏高的是①②⑦⑧.
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中;
②未等溶解的NaOH溶液和稀释后的H2SO4溶液冷却至室温就转移到容量瓶中;
③将溶液转移至容量瓶后,未洗烧杯和玻璃棒;
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出;
⑤容量瓶不干燥,含有少量蒸馏水;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线;
⑦定容时,俯视刻度线;
⑧用量筒量取浓硫酸时,仰视观察凹液面与量筒刻度线相切;
⑨转移溶液时不慎有少量洒到容量瓶外面.
分析 (1)配制溶液时的步骤为计算→称量或量取→溶解→冷却→转移→洗涤→定容→倒转摇匀;
(2)根据配置两种溶液的步骤分析所用到的仪器;
(3)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器;
(4)容量瓶选择遵循“大而近”的原则;先c=$\frac{1000ρω}{M}$计算浓硫酸的浓度,然后根据稀释定律计算浓硫酸的体积;
(5)依据托盘天平的使用方法读取烧杯的质量,依据m=cVM计算需要的氢氧化钠的质量;
(6)析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析,c与n成正比,c与V成反比.
解答 解:(1)配制溶液时,一般可以分为以下几个步骤:计算→称量或量取→溶解→冷却→转移→洗涤→定容→倒转摇匀,
故答案为:②①③⑧⑤⑥⑦④;
(2)称量NaOH的质量需要托盘天平和药匙,量取浓硫酸需要量筒,溶解NaOH或稀释硫酸需要用到玻璃棒、烧杯,转移到容量瓶中,定容需要胶头滴管,因此一直用不到的是烧瓶和分液漏斗,
故答案为:②⑨;
(3)容量瓶是配制一定体积准确浓度的标准溶液的主要仪器,容量瓶作为精密仪器不可用于储存和加热溶解固体、稀释液体,也不能测量除其规格以外容积的液体体积,
故答案为:BC;
(4)配制450mL0.5mol•L-1硫酸溶液时,由于没有450ml容量瓶,遵循“大而近”的原则,应选用500ml容量瓶;
质量分数 98%、密度为1.84g/cm3的浓硫酸的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,根据稀释定律可得18.4mol/L×V=500ml×0.5mol/L,解得V=13.6ml,
故答案为:500 mL容量瓶;13.6mL;
(5)托盘天平使用应遵循左物右码的原则,物码放反,则砝码的质量等于物的质量+游码的质量,则质量=砝码的质量-游码的质量,所以实际质量=30g-2.6g=27.4g,
要配置240ml 1mol•L-1NaOH溶液应选择250ml容量瓶,需要氢氧化钠的质量=1mol/L×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(6)①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致硫酸的物质的量偏大,所配溶液浓度偏高;
②未等溶解的NaOH溶液和稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,导致溶液的体积偏小,所配溶液浓度偏高;
③将溶液转移至容量瓶后,未洗烧杯和玻璃棒,导致溶质得物质的量偏小,所配溶液浓度偏低;
④定容时,加蒸馏水超过刻度线,导致溶液体积偏大,浓度偏小,又用胶头滴管吸出,所配溶液浓度仍偏低;
⑤容量瓶不干燥,含有少量蒸馏水,对n、V无影响,因此对浓度无影响;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,所配溶液浓度偏低;
⑦定容时,俯视刻度线,导致溶液体积偏小,浓度偏高;
⑧用量筒量取浓硫酸时,仰视观察凹液面与量筒刻度线相切,导致硫酸的物质的量偏大,所配溶液浓度偏高;
⑨转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,所配溶液浓度偏低;
故答案为:①②⑦⑧.
点评 本题考查较为综合,涉及一定物质的量浓度溶液的配制实验的步骤、仪器、数据处理和误差分析等,难度中等,其中误差分析情况较多,掌握有一定的难度.

 名校课堂系列答案
名校课堂系列答案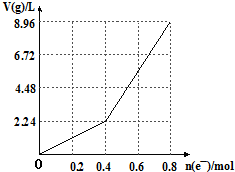
| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)═2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
①NH4Cl ②NaHSO4 ③NaCl ④CH3COONa ⑤Na2CO3.
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |
| A. | b>2a | B. | a=2b | C. | b=2a | D. | b<2a |

| A. | 溶液中一定有SO42-,可能有Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
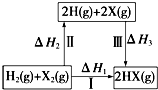
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
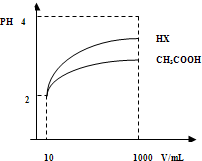 回答下列问题:
回答下列问题: