题目内容
14.在某澄清溶液中,可能存在以下几种离子:K+,Ba2+,H+,I-,SO42-,CO32-.取溶液进行如下实验:(1)该溶液可使pH试纸变红.
(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置.四氯化碳层呈紫色.(3)另取部分溶液,逐滴加入NaOH溶液,使溶液呈碱性后,再加入Na2CO3溶液,出现白色沉淀.
根据以上事实,原溶液肯定存在的离子是H+、Ba2+、I-;肯定不存在的离子是CO32-、SO42-;可能存在的离子是K+.
分析 在某澄清溶液中;根据实验(1)现象排除与强酸反应的离子弱酸根离子;根据实验(2)现象确定存在碘离子,能够与碘离子反应离子不能存在;根据实验(3)现象判断一定存在钡离子,排除与钡离子反应的离子,据此完成本题.
解答 解:由某澄清溶液中;根据实验(1)现象排除与强酸反应的离子弱酸根离子,排除与强酸反应的CO32-离子存在;
(2)取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置.四氯化碳层呈紫色,说明溶液中一定存在I-;
(3)另取部分溶液,逐滴加入NaOH溶液,使溶液呈碱性后,再加入Na2CO3溶液,出现白色沉淀,证明一定存在Ba2+,所以一定不存在与钡离子反应的SO42-,通过以上分析,该溶液中肯定存在的离子有:H+、Ba2+、I-;肯定不存在的离子有:CO32-、SO42-;可能存在的离子有:K+,
故答案为:H+、Ba2+、I-;CO32-、SO42-;K+.
点评 本题考查物质的检验与鉴别、常见离子的检验,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

练习册系列答案
相关题目
4.下列说法中正确的是( )
| A. | 氯化钾溶液在电流作用下电离成K+和Cl- | |
| B. | 氧化还原反应的本质是有化合价的升降 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 碱性氧化物均属于金属氧化物 |
5.已知氧化性:Cl2>Fe3+>S,则下列说法正确的是( )
| A. | Fe可以和S在加热条件下生成Fe2S3 | |
| B. | Cl2和H2S相遇可发生反应:H2S+Cl2═2HCl+S↓ | |
| C. | 在酸性溶液中,Fe3+和S2-可以大量共存 | |
| D. | Cl2可以氧化Fe3+ |
2.以石墨电极电解200mL CuSO4溶液,电解过程中电子转移物质的量n(e-)与产生气体总体积V(g)(标准状况)的关系如图所示.下列说法中(忽略溶液体积变化)正确的是( )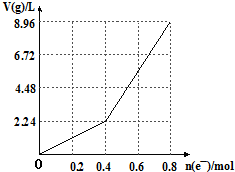

| A. | 电解前CuSO4溶液的物质的量浓度为2mol/L | |
| B. | 电解后所得溶液中c(H+)═2mol/L | |
| C. | 当n(e-)=0.6mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中加入16gCuO,则溶液可恢复为电解前的浓度 |
9.在pH都等于5的HCl和NH4Cl两种溶液中,设由水电离产生的H+离子浓度分别为A mol•L-1与B mol•L-1,则A和B的关系为( )
| A. | A>B | B. | A=10-4B | C. | B=10-4A | D. | A=B |
6.除去NaNO3 溶液中混有的AgNO3,所用下列试剂中效果最好的是( )
| A. | NaCl 溶液 | B. | NaBr 溶液 | C. | NaI 溶液 | D. | Na2S 溶液 |
4.常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示,下列有关说法正确的是( )

| A. | 溶液中一定有SO42-,可能有Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
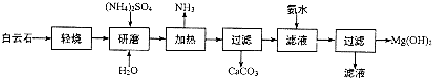
 回答下列问题:
回答下列问题: