题目内容
13.碳酸氢钠受热容易分解为碳酸钠.现加热90g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了31g,则原混合物中碳酸钠的质量为多少?分析 加热碳酸钠和碳酸氢钠的混合物,碳酸氢钠完全分解,根据反应的方程式2NaHCO3$\frac{\underline{\;加热\;}}{\;}$Na2CO3+CO2↑+H2O,利用差量法计算碳酸氢钠的质量,进而计算碳酸钠质量.
解答 解:碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有NaHCO3的质量为x,则
2NaHCO3$\frac{\underline{\;点燃\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84 62
x 31g
则:2×84:62=x:31g
解得:x=84g,
所以原混合物中碳酸钠的质量为:m(Na2CO3)=90g-m(NaHCO3)=90g-84g=6g,
答:原混合物中碳酸钠的质量为6克.
点评 本题考查混合物反应的计算,题目难度中等,注意碳酸氢钠、碳酸钠的化学性质,明确差量法在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
4.常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示,下列有关说法正确的是( )

| A. | 溶液中一定有SO42-,可能有Cl- | |
| B. | 溶液中一定不存在的只有Fe2+和CO32-两种离子 | |
| C. | 溶液中一定存在Al3+、Na+ | |
| D. | 生成的甲、乙两种气体均无色,且均易溶于水 |
1.下列说法正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
8.下列各组反应,前者是氧化还原反应,后者是非氧化原反应的是( )
| A. | 实验室制取O2;实验室制取H2 | B. | 实验室制取CO2;CO2通入石灰水中 | ||
| C. | 实验室电解水;CaO溶于水 | D. | 氢、氧混合气体爆鸣;蜡烛燃烧 |
18.下列事实不能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |
5.下列说法正确的是( )
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
2.关于如图所示转化关系(X代表卤族元素)说法正确的是( )
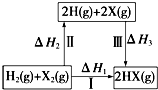

| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
3.下列关于浓硫酸叙述正确的是( )
| A. | 浓硫酸能使湿润的蓝色石蕊试纸先变红后变黑 | |
| B. | 浓硫酸在常温下可迅速与铜片反应,放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能使铁铝等金属钝化,加热条件下也不反应 |
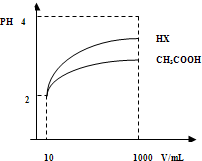 回答下列问题:
回答下列问题: