题目内容
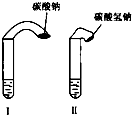 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:①试管中(填产生沉淀或气体及反应速率等相关现象)
②试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ?Ⅱ=
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.
其中得出的结论是否正确
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):(注:每组固体完全溶解且完全反应)
| 序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
| A | 50mL水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
| B | 50mL水 | 3.2g Na2CO3固体 | 20℃ | 23.3℃ |
| C | 50mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 17.4℃ |
| D | 50mL稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 24.4℃ |
①该研究报告的题目是
②该实验中所用的仪器除试管、药匙(或V形纸槽)、气球、下端带环状玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为
a:Na2CO3溶液和盐酸的反应是
b:NaHCO3溶液和盐酸的反应是
考点:探究吸热反应和放热反应
专题:实验设计题
分析:(1)①NaHCO3和Na2CO3与盐酸反应在同一条件下的速率不同,碳酸氢钠反应速率更快;
②根据碳酸钠、碳酸氢钠与二氧化碳的关系式计算大小气球体积之比;
③物质溶解吸热,会使温度降低;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;
②测量温度需要温度计、称量固体需要托盘天平;
a.由实验B、D反应中溶液温度变化判断碳酸钠与盐酸的反应中能量变化;
b.由实验A、C中温度变化判断碳酸氢钠与盐酸反应的能量变化.
②根据碳酸钠、碳酸氢钠与二氧化碳的关系式计算大小气球体积之比;
③物质溶解吸热,会使温度降低;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应;
②测量温度需要温度计、称量固体需要托盘天平;
a.由实验B、D反应中溶液温度变化判断碳酸钠与盐酸的反应中能量变化;
b.由实验A、C中温度变化判断碳酸氢钠与盐酸反应的能量变化.
解答:
解:(1)①装有NaHCO3溶液的试管中很快产生气泡,而装有Na2CO3溶液的试管中开始没有气泡产生,但随着滴入稀盐酸的量增加,才会产生气泡,
故答案是:两支试管中都产生气泡,但装有NaHCO3的试管中反应速率快得多;
②盐酸与碳酸钠反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3,
盐酸与碳酸氢钠反应的化学方程为:NaHCO3+HCl=NaCl+H2O+CO2↑,
根据二者与盐酸反应的化学方程式可知,Na2CO3的相对分子质量比NaHCO3的大,故相同质量的Na2CO3与NaHCO3中,NaHCO3与盐酸反应生成的CO2气体多一些.
碳酸钠、碳酸氢钠与二氧化碳的关系式分别为:
Na2CO3----CO2; NaHCO3----CO2;
106g 22.4L 84g 22.4L
0.3g 0.063L 0.3g 0.08L
所以试管中气球大小(包含试管)体积之比约为:Ⅰ:Ⅱ=0.063:0.08:=42:53,
故答案为:42:53;
③由于碳酸钠、碳酸氢钠溶解过程中会吸收热量,且物质的状态影响放出能量大小,不能根据用手触摸试管的冷热判断碳酸钠、碳酸氢钠与盐酸反应的反应热情况,
故答案为:不正确;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应,则该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究,
故答案为:碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究;
②测量温度需要温度计、称量固体需要托盘天平,
故答案为:温度计;托盘天平;
a.由实验B、D可知,碳酸钠与盐酸的反应后溶液的温度升高,可知该反应过程中放热热量,则碳酸钠与盐酸的反应为放热反应,
故答案为:放热;
b.根据实验A、C可知,当NaHCO3与盐酸反应后,混合溶液的温度降低,说明碳酸氢钠与盐酸的反应为吸热反应,
故答案为:吸热.
故答案是:两支试管中都产生气泡,但装有NaHCO3的试管中反应速率快得多;
②盐酸与碳酸钠反应的化学方程式为:Na2CO3+HCl=NaCl+NaHCO3,
盐酸与碳酸氢钠反应的化学方程为:NaHCO3+HCl=NaCl+H2O+CO2↑,
根据二者与盐酸反应的化学方程式可知,Na2CO3的相对分子质量比NaHCO3的大,故相同质量的Na2CO3与NaHCO3中,NaHCO3与盐酸反应生成的CO2气体多一些.
碳酸钠、碳酸氢钠与二氧化碳的关系式分别为:
Na2CO3----CO2; NaHCO3----CO2;
106g 22.4L 84g 22.4L
0.3g 0.063L 0.3g 0.08L
所以试管中气球大小(包含试管)体积之比约为:Ⅰ:Ⅱ=0.063:0.08:=42:53,
故答案为:42:53;
③由于碳酸钠、碳酸氢钠溶解过程中会吸收热量,且物质的状态影响放出能量大小,不能根据用手触摸试管的冷热判断碳酸钠、碳酸氢钠与盐酸反应的反应热情况,
故答案为:不正确;
(2)①反应前温度相同,改变酸及固体的量,探究反应中的热效应,则该研究报告的题目是碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究,
故答案为:碳酸钠、碳酸氢钠与盐酸反应过程中热效应的探究;
②测量温度需要温度计、称量固体需要托盘天平,
故答案为:温度计;托盘天平;
a.由实验B、D可知,碳酸钠与盐酸的反应后溶液的温度升高,可知该反应过程中放热热量,则碳酸钠与盐酸的反应为放热反应,
故答案为:放热;
b.根据实验A、C可知,当NaHCO3与盐酸反应后,混合溶液的温度降低,说明碳酸氢钠与盐酸的反应为吸热反应,
故答案为:吸热.
点评:本题以实验探究考查碳酸钠、碳酸氢钠的性质及与酸反应的热效应,题目难度中等,把握表格中实验数据的分析为解答的关键,注意变量控制法的应用.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
已知下列热化学方程式,则③中的Q3值为
Zn(s)+
O2(g)═ZnO (s)△H=-Q1 kJ?mol-1 ①
Hg(l)+
O2(g)═HgO (s)△H=-Q2 kJ?mol-1 ②
Zn(s)+HgO(s)═Hg(l)+ZnO (s)△H=-Q3 kJ?mol-1 ③( )
Zn(s)+
| 1 |
| 2 |
Hg(l)+
| 1 |
| 2 |
Zn(s)+HgO(s)═Hg(l)+ZnO (s)△H=-Q3 kJ?mol-1 ③( )
| A、Q2-Q1 |
| B、Q1+Q2 |
| C、Q1-Q2 |
| D、-Q1-Q2 |
某盐酸的物质的量浓度为12.0mol/L,其密度为1.19g/cm3,现有该浓度的盐酸100mL,则用于吸收HCl气体形成该盐酸的水的体积为( )
| A、75.2mL |
| B、85.5mL |
| C、90.8mL |
| D、100mL |
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.