题目内容
一定量的NH4ClO4完全分解,若实验时得到0.5mol N2,其它产物不含N元素,则分解的NH4ClO4的物质的量为 mol.
考点:化学方程式的有关计算
专题:计算题
分析:根据N原子守恒计算分解的NH4ClO4的物质的量.
解答:
解:一定量的NH4ClO4完全分解,若实验时得到0.5mol N2,其它产物不含N元素,根据N原子守恒可知:n(NH4ClO4)=2n(N2)=0.5mol×2=1mol,故答案为:1.
点评:本题考查质量化学方程式有关计算,涉及质量守恒定律,比较基础,注意从宏观与微观方面理解质量守恒定律.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B、原子半径由大到小的顺序为:Z>Y>W |
| C、W、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D、X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
下列离子方程式正确的是( )
| A、FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B、4 mol的Cl2通入含3molFeBr2的溶液中:2Fe2++6Br-+4Cl2=2Fe3++6Cl-+3Br2 |
| C、漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、NaHCO3水溶液里电离NaHCO3═Na++H++CO32- |
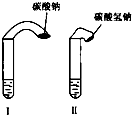 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: 选择下列实验方法分离物质,将分离方法的序号填在横线上.
选择下列实验方法分离物质,将分离方法的序号填在横线上.