题目内容
某盐酸的物质的量浓度为12.0mol/L,其密度为1.19g/cm3,现有该浓度的盐酸100mL,则用于吸收HCl气体形成该盐酸的水的体积为( )
| A、75.2mL |
| B、85.5mL |
| C、90.8mL |
| D、100mL |
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=cV计算HCl的物质的量,根据m=nM计算HCl的质量,再根据m=ρV计算溶液的质量,进而计算水的质量,再根据V=
计算水的体积.
| m |
| ρ |
解答:
解:100mL该盐酸溶液中HCl的物质的量=0.1L×12mol/L=1.2mol,溶液中HCl的质量=1.2mol×36.5g/mol=43.8g,溶液质量=100mL×1.19g/mL=119g,故需要水的质量=119g-43.8g=75.2g,水的密度为1g/mL,故需要水的体积=
=75.2mL,故选A.
| 75.2g |
| 1g/mL |
点评:本题考查物质的量浓度有关计算,难度不大,注意对公式的理解,有利于基础知识的巩固.

练习册系列答案
相关题目
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B、原子半径由大到小的顺序为:Z>Y>W |
| C、W、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D、X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
对于可逆反应2A+3B?2C;△H<0,下列条件的改变一定可以加快正反应速率的是( )
| A、增加压强 |
| B、升高温度 |
| C、增加A的量 |
| D、加入二氧化锰作催化剂 |
已知某溶液中存在较多的H+、NO3-、SO42-,则该溶液中还可能大量存在的离子组是( )
| A、Na+、Al3+、I- |
| B、NH4+、Cu2+、Cl- |
| C、Mg2+、Cl-、ClO- |
| D、Ba2+、Cl-、Br- |
下列物质的分离方法中,你认为不合理的是( )
| A、用萃取法把碘水中的碘与水分离 |
| B、用结晶法除去KNO3中混有的少量的NaCl |
| C、把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣 |
| D、用蒸馏法除去色拉油中混有的一定量的水 |
下列离子方程式正确的是( )
| A、FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O |
| B、4 mol的Cl2通入含3molFeBr2的溶液中:2Fe2++6Br-+4Cl2=2Fe3++6Cl-+3Br2 |
| C、漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| D、NaHCO3水溶液里电离NaHCO3═Na++H++CO32- |
下列关于各配合物的稳定性,判断不正确的是( )
| A、[Fe(CN)6]3->[Fe(SCN)6]3- |
| B、[HgCl4]2->[HgF4]2- |
| C、[AlF6]3->[AlBr6]3- |
| D、[Cu(NH3)4]2+>[Zn(NH3)4]2+ |
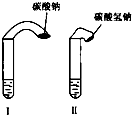 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: