题目内容
已知下列热化学方程式,则③中的Q3值为
Zn(s)+
O2(g)═ZnO (s)△H=-Q1 kJ?mol-1 ①
Hg(l)+
O2(g)═HgO (s)△H=-Q2 kJ?mol-1 ②
Zn(s)+HgO(s)═Hg(l)+ZnO (s)△H=-Q3 kJ?mol-1 ③( )
Zn(s)+
| 1 |
| 2 |
Hg(l)+
| 1 |
| 2 |
Zn(s)+HgO(s)═Hg(l)+ZnO (s)△H=-Q3 kJ?mol-1 ③( )
| A、Q2-Q1 |
| B、Q1+Q2 |
| C、Q1-Q2 |
| D、-Q1-Q2 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:依据题干热化学方程式,结合盖斯定律的内容是与起始状态和终了状态有关,与变化过程无关,进行计算.
解答:
解:①Zn(s)+
O2(g)═ZnO(s)△H1=-Q1 kJ/mol①
②Hg(l)+
O2(g)═HgO(s)△H2=-Q2 kJ/mol②
③Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H3=-Q3 kJ/mol③
依据热化学方程式和盖斯定律计算①-②得到:Zn(s)+HgO(s)=Hg(l)+ZnO(s)△H3=-Q3 kJ/mol=-(Q1-Q2)KJ/mol;
则Q3与Q1和Q2的关系式为:Q3=Q1-Q2,
故选C.
| 1 |
| 2 |
②Hg(l)+
| 1 |
| 2 |
③Zn(s)+HgO(s)═Hg(l)+ZnO(s)△H3=-Q3 kJ/mol③
依据热化学方程式和盖斯定律计算①-②得到:Zn(s)+HgO(s)=Hg(l)+ZnO(s)△H3=-Q3 kJ/mol=-(Q1-Q2)KJ/mol;
则Q3与Q1和Q2的关系式为:Q3=Q1-Q2,
故选C.
点评:本题考查了盖斯定律的计算应用,注意热化学方程式系数变化焓变随之变化,反应改变方向,焓变改变符号,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
两种一元弱酸的钠盐NaX和NaY,往NaX溶液中通入CO2只能生成HX和NaHCO3,往NaY溶液中通入CO2能生成HY和Na2CO3,则下列说法正确的是( )
| A、酸性:HX<HY |
| B、结合质子的能力:CO32->Y->X->HCO3- |
| C、相同条件下溶液的碱性:NaY>Na2CO3>NaX>NaHCO3 |
| D、HX和HY的酸性均比H2CO3强 |
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
| a | ||||
| b | ||||
| c | d | |||
| e |
| A、b元素除0价外,只有一种化合价 |
| B、五种元素中,c元素的性质最稳定 |
| C、b、d气态氢化物溶于水,溶液的酸性:b>d |
| D、e元素最高价氧化物的水化物和不同量的氢氧化钠溶液反应,可能生成三种盐 |
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)<c(X-),则下列关系正确的是( )
| A、c(OH-)<c(H+) |
| B、c(HX )>c(X-) |
| C、c(X-)+c(HX )=2c(Na+) |
| D、c(Na+)+c(OH-)=c(H+)-c(HX) |
下列各组物质中,相互间一定互为同分异构体的是( )
| A、淀粉和纤维素 |
| B、蔗糖和麦芽糖 |
| C、C4H6和C5H8 |
| D、氨基酸和蛋白质 |
用食用白醋(醋酸浓度约1mol/L)常温下进行下列实验,能证明醋酸为弱电解质的是( )
| A、白醋中滴入石蕊试液呈红色 |
| B、实验测得该白醋的pH为2.3 |
| C、蛋壳浸泡在白醋中有气体放出 |
| D、白醋加入豆浆中有沉淀产生 |
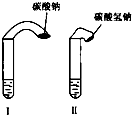 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: