题目内容
 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图1连接.(1)如果把电键K接A,Zn②的电极反应为
(2)上述反应进行5min后,转换电键K到B,Zn①的电极反应式是
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,此时该装置为
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图2所示.
正极上发生的电极反应为
阴极上发生的电极反应为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)如果把电键K接A,由图可知,为电解装置,Zn②与负极相连,为电解池阴极,发生还原反应生成铜,Zn①极为阳极,发生氧化反应;
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,发生Zn置换Cu的反应;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属为阳极,阴极发生还原反应;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气.
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,发生Zn置换Cu的反应;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属为阳极,阴极发生还原反应;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气.
解答:
解:(1)Zn②极为阴极,发生还原反应生成铜,电极方程式为Cu2++2e-=Cu,
故答案为:Cu2++2e-═Cu;
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,电极方程式为Zn-2e-═Zn2+,
故答案为:Zn-2e-═Zn2+;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属Zn为阳极,阴极发生还原反应,电极方程式为Zn2++2e-═Zn,
故答案为:电镀池;Zn2++2e-═Zn;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
正极反应的电极方程式为2H2O+O2+4e-═4OH-,乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2↑,
故答案为:2H2O+O2+4e-═4OH-;2H++2e-═H2↑.
故答案为:Cu2++2e-═Cu;
(2)反应进行5min后,转换电键K到B,为原电池装置,Zn①为负极,电极方程式为Zn-2e-═Zn2+,
故答案为:Zn-2e-═Zn2+;
(3)将Zn②换成铁片,电解质溶液换成ZnCl2饱和溶液,把电键K接A,为电镀装置,镀层金属Zn为阳极,阴极发生还原反应,电极方程式为Zn2++2e-═Zn,
故答案为:电镀池;Zn2++2e-═Zn;
(4)将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,甲形成原电池反应,锌为负极,铁为正极;
正极反应的电极方程式为2H2O+O2+4e-═4OH-,乙为电解反应,铁为阳极被氧化生成亚铁离子,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2↑,
故答案为:2H2O+O2+4e-═4OH-;2H++2e-═H2↑.
点评:本题考查原电池和电解质,侧重装置的分析及原理的考查,注意开关K的位置变化及发生的反应是解答的关键,题目难度中等.

练习册系列答案
相关题目
用食用白醋(醋酸浓度约1mol/L)常温下进行下列实验,能证明醋酸为弱电解质的是( )
| A、白醋中滴入石蕊试液呈红色 |
| B、实验测得该白醋的pH为2.3 |
| C、蛋壳浸泡在白醋中有气体放出 |
| D、白醋加入豆浆中有沉淀产生 |
已知某溶液中存在较多的H+、NO3-、SO42-,则该溶液中还可能大量存在的离子组是( )
| A、Na+、Al3+、I- |
| B、NH4+、Cu2+、Cl- |
| C、Mg2+、Cl-、ClO- |
| D、Ba2+、Cl-、Br- |
 (1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈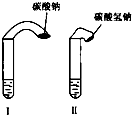 (1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下:
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸(均足量)(只有浓度小于1mol?L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3g NaHCO3和Na2CO3粉末的小气球分别套在两支试管口上.将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如下: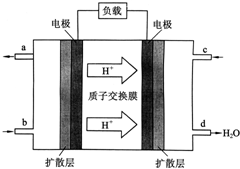 中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.
中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图所示.